ホスファチジルイノシトール(PI)3-キナーゼは、イノシトール環の3位をリン酸化する酵素で、PDGF受容体をはじめとするチロシンキナーゼ型増殖因子受容体や癌遺伝子産物と直接相互作用する性質をもつ。しかし、PI3-キナーゼの活性化がどのような細胞内機能の変化をもたらしうるのかについてはほとんど明らかではなかった。 私は本研究において、(1)強い生理作用をもつ真菌毒として知られていたが作用点が不明であったwortmanninがPI3-キナーゼの強力な阻害薬であることを見い出し、この薬物を用いることで、PI3-kinaseの生理的な機能について解析した。(2)これまでその詳細が不明であった三量体型GTP結合タンパク質を介するPI3-kinaseの活性化の機序について検討するなかで、特定のPI3-キナーゼがチロシンキナーゼとGタンパク質の両者による制御を受けることを新たに見い出した。 1.wortmanninを用いたPI3-kinaseの機能の解析 好中球を走化性因子であるfMLPで刺激した際には細胞応答として活性酸素産生が起こる。この活性酸素産生をwortmanninは阻害するが、このときPI3-キナーゼの反応生成物であるPI-3,4,5-P3の蓄積に対する阻害曲線と、活性酸素産生に対する阻害曲線はよく一致していた(Fig.1)。また、同様の阻害はwortmanninとは異なった機構でPI3-キナーゼを阻害するLY294002によっても観察された。すなわち、これまで指摘されていたような増殖や分化の情報伝達だけでなく、好中球のように分化した末梢細胞の細胞機能においてもPI3-キナーゼが必須の役割を担っていることが明らかになった。次に、好中球においてPI3-キナーゼの活性化の結果どのような細胞内機構の活性化が引き起こされるのかを検討する目的で、MAPキナーゼの活性化とNADPHオキシダーゼの細胞質因子であるp47phoxのリン酸化に対するwortmanninの作用を検討した。その結果、fMLP刺激によって引き起こされるMAPキナーゼの活性化とp47phoxのリン酸化は共にwortmanninによって阻害された。この結果はPI3-キナーゼの活性化の結果、セリンスレオニンキナーゼが活性化していることを示唆するものである。 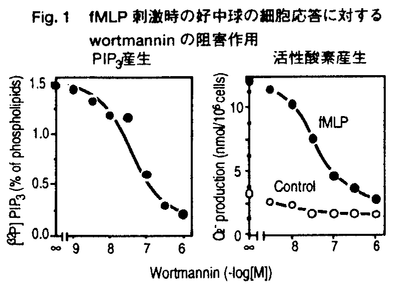 Fig.1 fMLP刺激時の好中球の細胞応答に対するwortmanninの阻害作用2.PI3-キナーゼの活性化の機構 Fig.1 fMLP刺激時の好中球の細胞応答に対するwortmanninの阻害作用2.PI3-キナーゼの活性化の機構 PI3-キナーゼ活性は広く様々な細胞に発現しており、多種多様なレセブター刺激によってその反応生成物が観察される。しかし、好中球の活性酸素産生を引き起こすfMLP刺激の場合のようなGタンパク質を介するPI3-キナーゼの活性化機構についてはこれまで全く不明であり、この場合に活性化するPI3-キナーゼがこれまでに知られているPI3-キナーゼと同一なのかどうかもわかっていない。そこでPI3-キナーゼの活性化の機序について検討した。 インスリンレセプターはチロシンキナーゼ内在型のレセプターで、細胞刺激時には細胞内の基質であるIRS-1がチロシンリン酸化され、PI3-キナーゼはこのIRS-1と結合することで活性化すると考えられている。そこでインスリン刺激で活性化するPI3-キナーゼとfMLP刺激で活性化するPI3-キナーゼが同一分子なのかどうかを調べる目的で、両アゴニストで細胞を同時に刺激した。血球系の培養細胞株であるTHP-1細胞では、インスリンとfMLPはそれぞれ単独でPIP3産生を引き起こした。そして興味深いことに両者で細胞を同時に刺激すると、相乗的なPIP3産生が観察された(Fig.2)。この相乗作用は細胞応答である活性酸素産生にも反映しており、この現象が生理的に意味のあるものであることが示唆された。インスリンで細胞を刺激した際には抗ホスホチロシン抗体によって免疫沈降した画分のPI3-キナーゼ活性が増大し、これが一般にはPI3-キナーゼの活性化の指標ともされるが、THP-1細胞をインスリンとfMLPの両者で刺激した場合、ホスホチロシン抗体免疫複合体中のPI3-キナーゼ活性はインスリン単独刺激の場合と同等であった(Fig.3)。このことはインスリンとfMLPによる相乗的なPIP3産生は、これまでPI3-キナーゼの活性化のメカニズムとされてきたチロシンリン酸化の経路では説明できないことを意味している。また、fMLP刺激によってこれまで知られていた分子とは全く異なるPI3-キナーゼが活性化すると考えても、ここでみられた相乗作用を説明することはできない。 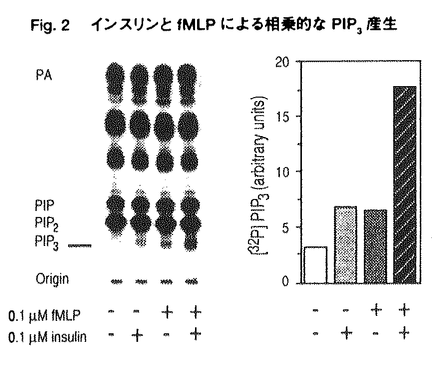 Fig.2 インスリンとfMLPによる相乗的なPIP3産生 Fig.2 インスリンとfMLPによる相乗的なPIP3産生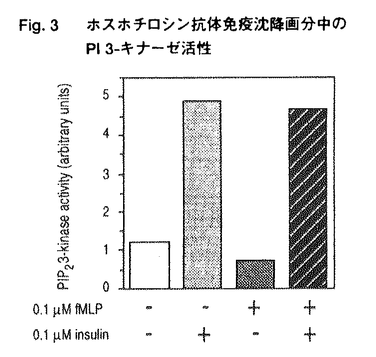 Fig.3 ホスホチロシン抗体免疫沈降画分中のPI3-キナーゼ活性 Fig.3 ホスホチロシン抗体免疫沈降画分中のPI3-キナーゼ活性 次に、インスリンとfMLPによる相乗的なPI3-キナーゼの活性化の機構についてさらに調べるために、THP-1細胞に存在するPI3-キナーゼの分子種について検討した。THP-1細胞の細胞質をMonoQカラムクロマトグラフィーで分離したところ、PI3-キナーゼ活性は大きくふたつのピークに分かれて溶出した(Fig.4,peakI,II)。既知のPI3-キナーゼに対する抗体を用いてイムノブロットを行った結果、これまでに知られているp85/p110型PI3-キナーゼはpeakIに溶出していた。 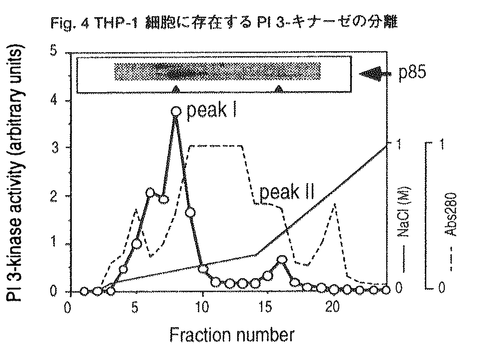 Fig.4 THP-1細胞に存在するPI3-キナーゼの分離 Fig.4 THP-1細胞に存在するPI3-キナーゼの分離 2種類の酵素の性質を、ウシ脳より精製した三量体型Gタンパク質の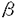 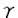 サブユニットと、PI3-キナーゼのSH2領域が結合する配列(YMXMモチーフ)に基づいて作製したチロシンリン酸化ペプチドを用いて検討した。すると、peakIIのPI3-キナーゼは サブユニットと、PI3-キナーゼのSH2領域が結合する配列(YMXMモチーフ)に基づいて作製したチロシンリン酸化ペプチドを用いて検討した。すると、peakIIのPI3-キナーゼは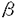 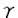 サブユニットによって強く活性化し、一方でチロシンリン酸化ペプチドでは全く活性化しなかったことから、最近その存在が報告されているGタンパク質によって活性化するこれまで知られていなかったPI3-キナーゼサブタイプが、THP-1細胞にも存在することが明らかとなった。次にp85/p110型PI3-キナーゼであると予測しているpeakIの画分では、予想に反してGタンパク質 サブユニットによって強く活性化し、一方でチロシンリン酸化ペプチドでは全く活性化しなかったことから、最近その存在が報告されているGタンパク質によって活性化するこれまで知られていなかったPI3-キナーゼサブタイプが、THP-1細胞にも存在することが明らかとなった。次にp85/p110型PI3-キナーゼであると予測しているpeakIの画分では、予想に反してGタンパク質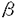 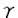 サブユニットはこちらの画分の活性も増大させることが観察された。更にpeakIの両分では サブユニットはこちらの画分の活性も増大させることが観察された。更にpeakIの両分では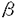 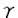 サブユニットの濃度依存性がpeakIIとは全く異なっており、単独の作用は弱いものの、チロシンリン酸化ペプチドを同時に添加することで、活性が相乗的に増大することを見い出した(Fig.5)。このように サブユニットの濃度依存性がpeakIIとは全く異なっており、単独の作用は弱いものの、チロシンリン酸化ペプチドを同時に添加することで、活性が相乗的に増大することを見い出した(Fig.5)。このように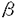 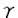 サブユニットとチロシンリン酸化ペプチドが相乗的に作用することは、ここでみられる活性が単一の分子によって担われていることを示唆するものであるが、このような性質を示すPI3-キナーゼについてはこれまで全く報告がない。 サブユニットとチロシンリン酸化ペプチドが相乗的に作用することは、ここでみられる活性が単一の分子によって担われていることを示唆するものであるが、このような性質を示すPI3-キナーゼについてはこれまで全く報告がない。 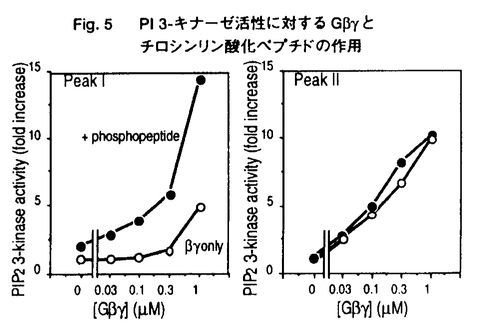 Fig.5 PI3-キナーゼ活性に対するG Fig.5 PI3-キナーゼ活性に対するG 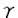 とチロシンリン酸化ペプチドの作用 とチロシンリン酸化ペプチドの作用 そこでこの画分(peakI)に存在するPI3-キナーゼが本当にp85/p110型だけなのかを確認するために、p85に対する抗体を用いて免疫沈降を行った後、上清中の活性を測定すると、PI3-キナーゼ活性は完全に免疫沈降されてp85タンパク質、活性共に上清では消失していた。また、p85に対するモノクローナル抗体で免疫沈降を行い、この免疫沈降画分に対する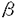 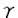 サブユニットの効果を検討したところ、 サブユニットの効果を検討したところ、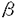 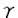 サブユニットがPI3-キナーゼ活性を大きく上昇させた(Fig.6)。 サブユニットがPI3-キナーゼ活性を大きく上昇させた(Fig.6)。 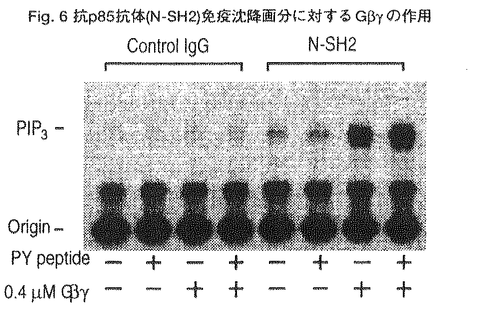 Fig.6抗p85抗体(N-SH2)免疫沈降画分に対するG Fig.6抗p85抗体(N-SH2)免疫沈降画分に対するG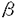 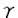 の作用まとめ の作用まとめ 以上の結果はTHP-1細胞に存在して既知のp85に対する抗体で認識されるPI3-キナーゼサブタイプが、チロシンリン酸化タンパク質とGタンパク質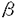 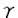 サブユニットの両者によって相乗的な活性化を受けることを示している。 サブユニットの両者によって相乗的な活性化を受けることを示している。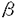 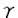 サブユニットが直接この酵素に結合しているのかどうかは今後の課題といえるが、チロシンキナーゼとGタンパク質からの情報の両者によって単一の酵素活性が制御されるという機構は、PI3-キナーゼのみにとどまらずこれまで他の酵素でも報告のないものであり、細胞の生理応答を考える上で非常に興味深いと思われる。 サブユニットが直接この酵素に結合しているのかどうかは今後の課題といえるが、チロシンキナーゼとGタンパク質からの情報の両者によって単一の酵素活性が制御されるという機構は、PI3-キナーゼのみにとどまらずこれまで他の酵素でも報告のないものであり、細胞の生理応答を考える上で非常に興味深いと思われる。 references 1.Okada,T.,Hazeki,O.,Ui,M.,Katada,T.(1996)Biochem.J,in press 2.Okada,T.,Sakuma,L.,Fukui,Y.,Hazeki,O.,and Ui,M.(1994)J.Biol.Chem.269,3563-3567 3.Okada,T.,Kawano,Y.,Sakakibara,T.,Hazeki,O.,and Ui,M.(1994)J.Biol.Chem.269,3568-3573 |