ヒト前骨髄球性白血病細胞株HL-60細胞は、レチノイン酸によって顆粒球様細胞へと分化するが、この分化に先だってNAD+をニコチンアミドとADPリボースに分解するNAD+グリコヒドロラーゼ活性が細胞膜上に誘導される。細胞外に触媒部位を向けたこの酵素の実体は長い間不明であったが、1993年当教室において、この活性がヒト細胞表面抗原であるCD38によって担われていることを明らかにした。CD38は、血球系細胞における種々の分化段階や活性化状態で複雑な発現を示す表面抗原であるが、その機能についてはほとんど明らかにされていない。一方、CD38は、同じくNAD+を基質とするアメフラシの環状ADPリボース生成酵素とアミノ酸配列上の相同性を有しており、CD38もNAD+から環状ADPリボースを生成する活性を弱いながらも有することが、その後示された。生成物の環状ADPリボースは、IP3受容体を介したCa2+動員とは異なった機序で、細胞内Ca2+動員を引き起こす物質として近年提唱されており、CD38は哺乳動物の環状ADPリボース生成酵素として注目を集めるにいたった。しかし、CD38は、NAD+を基質として、ADPリボースと環状ADPリボースを生成する多機能性酵素であり、その二つの酵素活性は、NAD+グリコヒドロラーゼ活性:環状ADPリボース生成活性=100:1と圧倒的にADPリボースの生成に傾いている。従って、環状ADPリボース生成酵素としてのCD38の役割には疑問が持たれている。また、CD38の有する酵素活性とその機能を結びつける知見は、これまで得られていない。そこで本研究において、CD38の酵素特性を環状ADPリボース生成側へと転換させるような因子の検索を試み、Zn2+にそのような効果があることを見いだし、その特性転換機構を解析した。また、血球系細胞において、CD38が実際に、細胞内で環状ADPリボース生成酵素として機能する可能性について検討した。 1.Zn2+によるCD38の酵素特性の転換 CD38の酵素活性変動を検討する標品として、組換えCD38蛋白質を大腸菌で発現させ、精製した。ヒトCD38の細胞外領域をマルトース結合蛋白質との融合蛋白質(MBP-CD38)として作製し、アフィニティー精製したMBP-CD38を6Mグアニジン塩酸処理後、界面活性剤中で透析することで、約0.5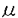 mol/min/mgのNAD+分解活性を有する高比活性の組換えCD38蛋白質が得られた。このMBP-CD38の二つの酵素活性に対する各種二価イオンの効果を検討したところ、Zn2+がNAD+グリコヒドロラーゼ活性の抑制と同時に環状ADPリボース生成活性を上昇させた(図1)。この効果は、レチノイン酸で誘導されるHL-60細胞の細胞膜表層上のCD38においても観察され、10 mMのZn2+存在下、環状ADPリボース生成活性のNAD+グリコヒドロラーゼ活性に対する比率は約30%にまで上昇した。 mol/min/mgのNAD+分解活性を有する高比活性の組換えCD38蛋白質が得られた。このMBP-CD38の二つの酵素活性に対する各種二価イオンの効果を検討したところ、Zn2+がNAD+グリコヒドロラーゼ活性の抑制と同時に環状ADPリボース生成活性を上昇させた(図1)。この効果は、レチノイン酸で誘導されるHL-60細胞の細胞膜表層上のCD38においても観察され、10 mMのZn2+存在下、環状ADPリボース生成活性のNAD+グリコヒドロラーゼ活性に対する比率は約30%にまで上昇した。 次に、NAD+グリコヒドロラーゼ活性に対するZn2+の阻害様式を速度論的に解析したところ、Zn2+による抑制は不拮抗阻害(uncompetitive inhibition)の様式を示した(図2.A)。従って、Zn2+はfreeの酵素ではなく、酵素基質複合体に対して阻害効果を及ぼしていることが示された。一方、同じ反応条件下で、Zn2+は、NAD+に対するKm値は変化させずに、環状ADPリボース合成活性のVmax値のみを上昇させた(図2.B)。 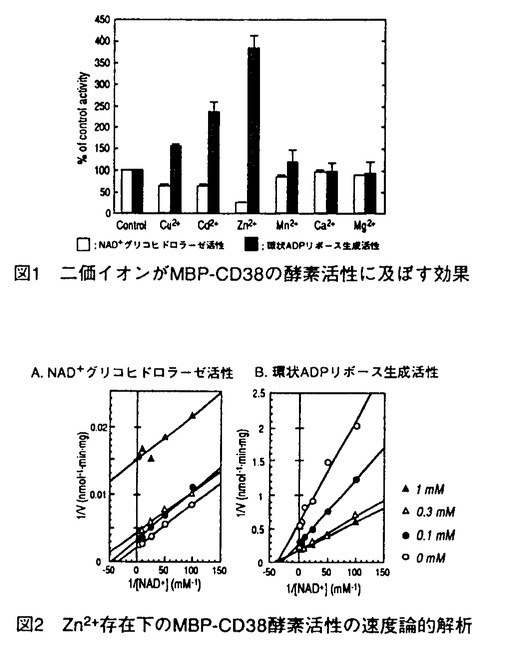 図表図1 二価イオンがMBP-CD38の酵素活性に及ぼす効果 / 図2 Zn2+存在下のMBP-CD38酵素活性の速度論的解析 図表図1 二価イオンがMBP-CD38の酵素活性に及ぼす効果 / 図2 Zn2+存在下のMBP-CD38酵素活性の速度論的解析 さらに、Zn2+がCD38の高次構造に及ぼす効果について、8-anilino-1-naphthalenesul fonate(ANS)を用いて検討した。ANSは蛋白質の疎水領域に結合して蛍光を発する蛍光プローブであるが、MBP-CD38の添加によってその蛍光強度は約5倍に上昇し、蛍光スペクトルのピークが520nmから484nmにシフトした。そこに1mMのZn2+を添加すると、MBP-CD38による蛍光強度の上昇は著しく増強された(図3)。この効果は同じ濃度のCa2+やMg2+の添加では認められず、また、Zn2+の効果はEDTAの添加によって完全に消失した。従って、Zn2+存在下、CD38に可逆的な高次構造変化が生じていることが示された。CD38が触媒するNAD+グリコヒドロラーゼ反応と環状ADPリボース生成反応には共通の酵素基質複合体が想定されるが、Zn2+によるCD38の高次構造変化によってその酵素基質複合体に対する水分子の接近が妨げられた結果、ヒドロラーゼ活性が抑制されて、CD38の酵素特性が環状ADPリボース生成側へと転換するものと考えられた。 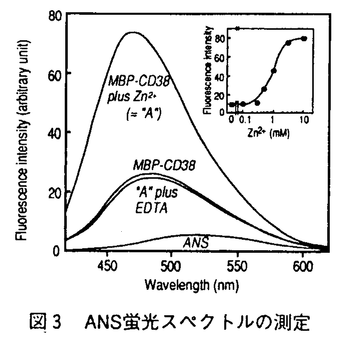 図3 ANS蛍光スペクトルの測定 図3 ANS蛍光スペクトルの測定 また、CD38分子内の機能部位を特定するために、プロテアーゼによるMBP-CD38の限定分解を検討したところ、線溶系ブロテアーゼであるプラスミンによって酵素活性を保持したままCD38の分解が起こることを見出した。この酵素活性を有したCD38蛋白質断片を、ハイドロキシアパタイトクロマトグラフィーによって精製し、活性断片に対するZn2+の効果を調べた。すると、この活性断片では、Zn2+がMBP-CD38に対して示した効果が全く認められなかった。従って、CD38の分子内には、酵素活性を担う部位と、少なくともZn2+が作用して酵素活性に影響を与える部位との、二つの機能部位が存在することが示唆された。 2.diethylpyrocarbonate(DEPC)によるCD38の化学修飾 CD38の酵素活性における活性中心のアミノ酸残基を検索する目的で、化学修飾剤であるDEPCを用いてMBP-CD38の活性修飾を検討した。その結果、MBP-CD38のNAD+グリコヒドロラーゼ活性は、DEPCの濃度と反応時間に依存して消失した。失活機構の速度論的解析から、DEPCによる修飾は、酵素との複合体形成を介さない二分子反応であり、活性に必須の一個のアミノ酸残基が修飾されることが示された。また、DEPCによる化学修飾の効果は、ヒドロキシアミンの処理によって除去されたことから、ヒスチジン残基、もしくはチロシン残基が修飾の標的アミノ酸と考えられた。そこで、ヒト、マウス、ラットのCD38、アメフラシの環状ADPリボース生成酵素の間で保存されているヒスチジン、チロシン残基を他のアミノ酸で置換した変異CD38蛋白質を用いてDEPCによる化学修飾を検討したところ、133番と244番ヒスチジン、152番チロシンはDEPCによる修飾アミノ酸ではないことが示された。従って、他のヒスチジン、チロシン残基がDEPCによる修飾アミノ酸と考えられた。 3.CD38による細胞内環状ADPリボースの蓄積 CD38は酵素の特性転換によって有意な環状ADPリボース合成活性を示し得ることから、CD38が細胞において環状ADPリボース生成酵素として機能する可能性を検討した。HL-60細胞を各種の分化誘導剤で処理すると、レチノイン酸処理でのみCD38の発現がみられるが、その時、細胞内環状ADPリボースの蓄積が観察された(図4)。この蓄積の時間経過は、細胞膜上におけるCD38の誘導よりも遅れて進行し、細胞外のNAD+の要求性は認められなかった。次に、蓄積が細胞内のどの部位で起こっているかを検討したところ、細胞質や核、形質膜ではなく、顆粒画分に環状ADPリボース蓄積が認められた。さらに、この顆粒の膜画分にも、抗CD38ボリクローナル抗体で認識されるような、細胞膜上のCD38と同じ分子量のCD38が存在していた(図5)。従って、CD38が細胞内の顆粒構造内で環状ADPリボースを生成する機能を有することが示唆された。CD38の環状ADPリボース合成活性はpH4で最大の活性を示し、逆にNAD+グリコヒドロラーゼ活性は抑制されたことから、リソソームなどの顆粒内の低pH環境下にCD38が効率よく環状ADPリボースを合成している可能性が考えられた。 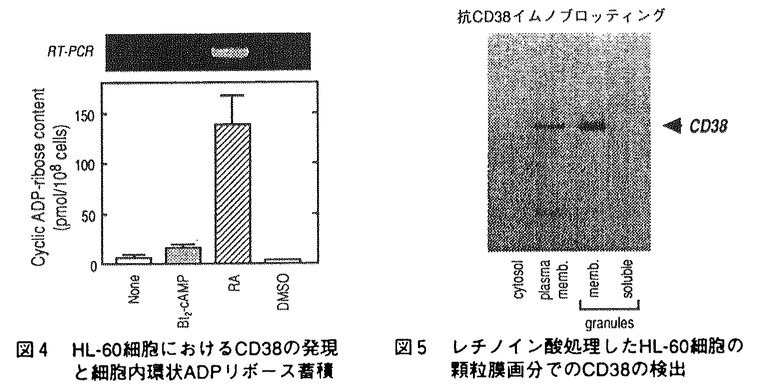 図表図4 HL-60細胞におけるCD38の発現と細胞内環状ADPリボース蓄積 / 図5 レチノイン酸処理したHL-60細胞の顆粒膜画分でのCD38の検出まとめ 図表図4 HL-60細胞におけるCD38の発現と細胞内環状ADPリボース蓄積 / 図5 レチノイン酸処理したHL-60細胞の顆粒膜画分でのCD38の検出まとめ CD38は、Zn2+の存在下に、NAD+加水分解から環状ADPリボース生成へと酵素の特性転換を引き起こすことが示された。従って、血中や細胞内の乃Zn2+がCD38の酵素特性を可逆的に制御していることが期待される。また、CD38の発現と細胞内の環状ADPリボース蓄積の間には相関があり、レチノイン酸処理したHL-60細胞では、CD38が細胞内顆粒にも存在し、顆粒内での環状ADPリボース生成に寄与していることが示唆された。この結果はCD38が細胞内で環状ADPリボース生成酵素として機能している可能性を初めて示すものであり、今後、細胞内に蓄積された環状ADPリボースの生理的役割を明らかにすることが、CD38の真の機能解明につながると考えられる。 |