| 内容要旨 | | ホスファチジルイノシトール3-キナーゼ(PI3-キナーゼ)はホスファチジルイノシトール(PI)の3位の水酸基をリン酸化する酵素であり、細胞の増殖や分化を制御する重要な情報因子である。この酵素は調節サブユニットであるp85と、触媒サブユニットであるp110から成るヘテロダイマーである。PI3-キナーゼは元来増殖因子受容体や癌遺伝子産物といった活性化したチロシンキナーゼと会合する脂質キナーゼとして同定された。活性化したチロシンキナーゼは細胞内基質のYXXM配列中のチロシン残基をリン酸化し、リン酸化されたこの部位にp85のsrchomology region 2(SH2)領域が特異的に結合する。PI3-キナーゼにYXXM配列を含むリン酸化ペプチドを添加するとPI3-キナーゼの活性が上昇することが報告されていることもあり、PI3-キナーゼの活性化はリン酸化チロシンがp85のSH2領域に結合することによってなされるという説が支配的である。一方最近、白血球中の走化性因子(fMLP)受容体等のGタンパク質共役型の受容体の活性化により、PI3-キナーゼの細胞内生成物であるPI(3,4,5)P3の産生が認められている。ヒト白血球中に、p85-p110ヘテロダイマーと異なりGタンパク質の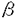 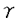 サブユニットによって活性化されるPI3-キナーゼが存在することを示唆する知見が相次いで出される中、今年ついにそのようなPI3-キナーゼの一つであるp110 サブユニットによって活性化されるPI3-キナーゼが存在することを示唆する知見が相次いで出される中、今年ついにそのようなPI3-キナーゼの一つであるp110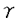 がクローニングされた。これらの知見よりfMLPによるPI(3,4,5)P3の産生はGタンパク質の がクローニングされた。これらの知見よりfMLPによるPI(3,4,5)P3の産生はGタンパク質の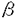 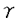 サブユニットによって活性化される(p85-p110ヘテロダイマーとは異なる)PI3-キナーゼによるといわれている。 サブユニットによって活性化される(p85-p110ヘテロダイマーとは異なる)PI3-キナーゼによるといわれている。 タチナタマメ由来のレクチンであるコンカナバリンA(Con A)は、マイトジェン作用を始めとする高い生物活性を持ち、食細胞を強く活性化するので炎症部位における細胞応答に良いモデルを提供する試薬である。Con Aは4価のレクチンで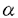 -D-マンノースと -D-マンノースと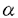 -D-グルコースに特異的に結合し、細胞表面の糖タンパク質を架橋することによって様々な細胞応答を引き起こすとされている。 -D-グルコースに特異的に結合し、細胞表面の糖タンパク質を架橋することによって様々な細胞応答を引き起こすとされている。 今回私はCon AがPI3-キナーゼの活性化に関わる2つの因子であるチロシンキナーゼとGタンパク質の両方を活性化することに着目し、食細胞をCon Aによって刺激した際のPI3-キナーゼの活性化機構と、PI3-キナーゼが食細胞の生体防御反応に貢献している可能性について検討した。 実験方法 1)タンパク質のチロシンリン酸化の測定:細胞を刺激後NP-40で可溶化し、抗ホスホチロシン抗体で免疫沈降とWestern blotingをすることによってリン酸化チロシンを定量化した。抗体と結合したタンパク質の検出には125I-protein Gを用いた。2)免疫沈降画分中のPI3-キナーゼの活性測定:Con Aで刺激した細胞をNP-40で可溶化し、抗ホスホチロシン抗体(PY20)で免疫沈降した後、免疫沈降画分を基質のPIや[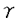 -32P]ATPと共に37℃でインキュベートし、産生したPI(3)Pの放射活性を測った。3)PI(3,4,5)P3の産生:細胞を32PIで標識し、刺激後脂質を抽出して薄層クロマトグラフィーで分離し、PI(3,4,5)P3中の放射活性を測定した。4)活性酸素(O2)産生:産生したO2によって還元されたシトクロームcの量を550nm波長の吸光度によって定量した。5)細胞の前処理:百日咳毒素(PT)前処理は100ng/mlで4時間、ワートマニン前処理は1 -32P]ATPと共に37℃でインキュベートし、産生したPI(3)Pの放射活性を測った。3)PI(3,4,5)P3の産生:細胞を32PIで標識し、刺激後脂質を抽出して薄層クロマトグラフィーで分離し、PI(3,4,5)P3中の放射活性を測定した。4)活性酸素(O2)産生:産生したO2によって還元されたシトクロームcの量を550nm波長の吸光度によって定量した。5)細胞の前処理:百日咳毒素(PT)前処理は100ng/mlで4時間、ワートマニン前処理は1 Mで10分間インキュベートすることによって行った。百日咳毒素は百日咳毒素感受性Gタンパク質(Gi)を化学修飾することによってGiを介するシグナルを遮断し、ワートマニンは低濃度でPI3-キナーゼを特異的に阻害する。 Mで10分間インキュベートすることによって行った。百日咳毒素は百日咳毒素感受性Gタンパク質(Gi)を化学修飾することによってGiを介するシグナルを遮断し、ワートマニンは低濃度でPI3-キナーゼを特異的に阻害する。 結果と考察1)Con A刺激によるタンパク質のチロシンリン酸化 細胞をCon Aで刺激すると様々なタンパク質のチロシンリン酸化が15秒以内に観察され、1分で最大になりその後速やかに減弱していった。チロシンリン酸化される115Kと95Kのタンパク質の中には、それぞれ癌原遺伝子産物のCbl(図1D,E)とVavが含まれることがわかった。タンパク質のチロシンリン酸化は、PT前処理によってもワートマニン前処理によっても影響を受けなかった。 2)Con A刺激時のPI3-キナーゼの活性化 PI3-キナーゼはリン酸化チロシンによって活性化するといわれているので、抗ホスホチロシン抗体(PY20)免疫沈降画分中のPI3-キナーゼの活性を測定した。Con A刺激によってPY20免疫沈降画分中のPI3-キナーゼ活性が増大し(図1C)、タンパク質のチロシンリン酸化と同様な経時変化を示した。刺激時にPY20免疫沈降画分中のPI3-キナーゼのp85サブユニットが増大することはWestern blotingで確認した(図1B)。またCon A刺激時には抗Cbl抗体免疫沈降画分中にもPY20免疫沈降画分と同程度のPI3-キナーゼ活性が認められた(図1G)。またCon Aによってチロシンリン酸化されたCblとp85が会合することはWestern blotingによって確認しており(図1F)、刺激時にPI3-キナーゼと会合するチロシンリン酸化タンパク質のほとんどはCblであると考えられた。VavはCblと同様にチロシンリン酸化されるが、Con A刺激時に抗Vav抗体免疫沈降画分中にPI3-キナーゼ活性は存在しなかった。Vavは低分子量Gタンパク質であるRasのGDP/GTP交換因子であるので、Con AによるVavのチロシンリン酸化はRasへのシグナルを仲介しているのかもしれない。 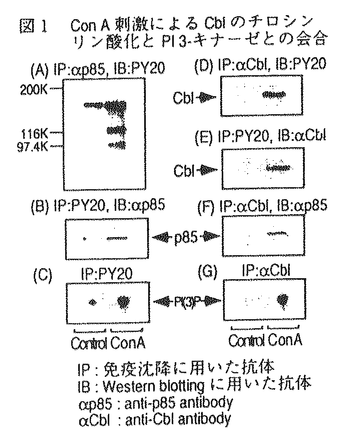 図1 Con A刺激によるCblのチロシンリン酸化とPI3-キナーゼとの会合 図1 Con A刺激によるCblのチロシンリン酸化とPI3-キナーゼとの会合 続いてPI3-キナーゼによる細胞内生成物であるPI(3,4,5)P3の産生を測定した。すると経時変化、Con A濃度依存性、及びPT感受性においてPY20免疫沈降画分中のPI3-キナーゼ活性の増加とは異なる性質を示した(表1)。Con A刺激によるPI(3,4,5)P3の産生にはリン酸化チロシンに結合するp85-p110ヘテロダイマー型のPI3-キナーゼの活性の寄与は少なく、代わってGiを介したシグナルが活性化するPI3-キナーゼが関与していることが示唆された。一方この細胞をインスリンで刺激してもPY20免疫沈降画分中のPI3-キナーゼ活性が増大し、PI(3,4,5)P3の産生が起こるが、どちらも同様のEC50値を示し、PT前処理によって影響を受けなかった。すなわちこの細胞内ではGiを介さないでPI(3,4,5)P3を産生させる経路も存在すると考えられた。  表1 Con A刺激によるPI(3,4,5)P3産生とPY20免疫沈降画分中のPI3-キナーゼ活性の増大の相違点3)活性酸素(O2-)の産生 表1 Con A刺激によるPI(3,4,5)P3産生とPY20免疫沈降画分中のPI3-キナーゼ活性の増大の相違点3)活性酸素(O2-)の産生 Con A刺激に対する細胞の最終応答としてO2-の産生を測定した。Con A刺激に対するO2-産生はCon Aの濃度依存的に増大し、細胞をワートマニンで前処理することによってワートマニン濃度依存的に抑制された。またPT前処理によっても強く抑制された。Con Aやワートマニンに対する濃度依存性がPI(3,4,5)P3産生と極めて類似していることやPI(3,4,5)P3産生と同様にPT前処理によって強く抑制されることからCon AによるO2-の産生にはPI(3,4,5)P3産生が関与していると考えられる(図2)。Con A刺激によるO2-の産生は刺激時に -D-メチルマンノースや -D-メチルマンノースや -D-フェニルマンノース、fMLPのアンタゴニストであるt-Boc-MLPを添加することによって強く抑制された。したがってこのO2-の産生は確かにレクチン作用によって引き起こされたものであり、少なくともその一部はfMLP受容体を架橋することによって引き起こされることが示唆された。 -D-フェニルマンノース、fMLPのアンタゴニストであるt-Boc-MLPを添加することによって強く抑制された。したがってこのO2-の産生は確かにレクチン作用によって引き起こされたものであり、少なくともその一部はfMLP受容体を架橋することによって引き起こされることが示唆された。 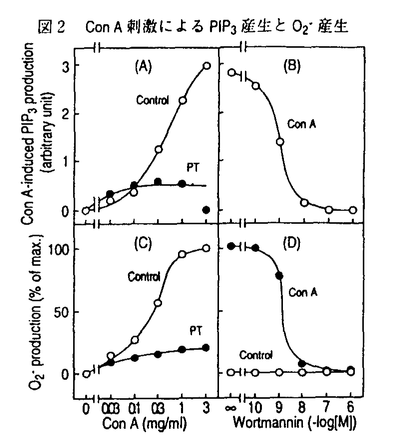 図2 Con A刺激によるPIP3産生とO2-産生結論 図2 Con A刺激によるPIP3産生とO2-産生結論 1)低濃度のCon A刺激によってCblやVavを始めとする種々のタンパク質がチロシンリン酸化され、チロシンリン酸化タンパク質とPI3-キナーゼとの会合が進行した。PI3-キナーゼと会合するチロシンリン酸化タンパク質の大部分はCblであった。 2)高濃度のCon A刺激によってPI(3,4,5)P3が産生され、その産生はリン酸化チロシン結合性よりもむしろ、Gi応答性のPI3-キナーゼによるものであった。 3)高濃度のCon A刺激によるO2-産生にはPI(3,4,5)P3の産生が関与しており、少なくともその一部はfMLP受容体の架橋によるものと考えられた。 参考文献1.Matsuo,T.,Hazeki,K.,Hazeki,O.,Katada,T.,and Ui,M.(1996)Biochem.J.,in press.2.Matsuo,T.,Hazeki,K.,Hazeki,O.,Katada,T.,and Ui,M.(1996)FEBS lett.,in press. |
| 審査要旨 | | ホスファチジルイノシトール(PI)3-キナーゼはイノシトール環の3位水酸基をリン酸化する酵素で、細胞内では主にPI-4,5-P2を基質としてPI-3,4,5-P3(PIP3)を産生する。本酵素はチロシンキナーゼ型受容体と会合することより、細胞増殖への関与が重要視されてきたが、近年好中球や血小板等の末梢細胞における細胞機能への役割も注目されており、食細胞では走化性因子による活性酸素(O2-)の産生やFc受容体を介した貪食などへの関与が指摘されている。一方、種々の生理活性作用をもつコンカナバリンA(Con A)は、4価のレクチンで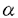 -D-マンノースと -D-マンノースと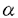 -D-グルコースに特異的に結合し、細胞表面の糖蛋白質を架橋することによって様々な細胞応答を惹起すると考えられている。Con AはチロシンキナーゼとG蛋白質の両方の経路を活性化する試薬として、PI3-キナーゼの活性化機構を解析するにあたって有用なツールであると考えられた。「コンカナバリンAによる食細胞の活性化におけるイノシトールリン脂質3-キナーゼの関与」と題する本論文では、単球系のTHP-1細胞をCon Aで刺激した際のPI3-キナーゼの活性化機構を解析し、食細胞におけるO2の産生機構の解明が試みられている。 -D-グルコースに特異的に結合し、細胞表面の糖蛋白質を架橋することによって様々な細胞応答を惹起すると考えられている。Con AはチロシンキナーゼとG蛋白質の両方の経路を活性化する試薬として、PI3-キナーゼの活性化機構を解析するにあたって有用なツールであると考えられた。「コンカナバリンAによる食細胞の活性化におけるイノシトールリン脂質3-キナーゼの関与」と題する本論文では、単球系のTHP-1細胞をCon Aで刺激した際のPI3-キナーゼの活性化機構を解析し、食細胞におけるO2の産生機構の解明が試みられている。 Con A刺激とFc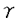 受容体IIの架橋刺激によるCblのチロシンリン酸化とPI3-キナーゼとの会合 受容体IIの架橋刺激によるCblのチロシンリン酸化とPI3-キナーゼとの会合 THP-1細胞をCon Aで刺激すると、刺激後約1分をピークに多くの蛋白質のチロシンリン酸化が観察されたが、この中には癌原遺伝子産物であるCblとRasのGTP/GDP交換因子であるVavが存在した。さらに、Con A刺激時にCblとPI3-キナーゼの会合が認められたが、VavとPI3-キナーゼとの会合は観察されなかった。Cblのチロシンリン酸化及びPI3-キナーゼとの会合は、G蛋白質(Gi)とPI3-キナーゼのそれぞれの阻害薬である百日咳毒素とwortmanninによっては抑制されなかった。一方、免疫グロブリンIgGのFc部分を認識し貪食作用を担うFc 受容体のFc 受容体のFc RIIを架橋刺激した際にも、Cblのチロシンリン酸化とPI3-キナーゼとの会合が観察された。 RIIを架橋刺激した際にも、Cblのチロシンリン酸化とPI3-キナーゼとの会合が観察された。 Con A刺激によるPIP3産生 細胞をCon A刺激すると15秒以内にPIP3の産生が観察された。このPIP3産生はCblなどのチロシンリン酸化及びチロシンリン酸化蛋白質とPI3-キナーゼの会合よりも早く進行し、より高濃度のCon A刺激で観察された。また、このPIP3産生は百日咳毒素前処理によってほぼ完全に抑制された。細胞をインスリンで刺激したときは、チロシンリン酸化蛋白質とPI3-キナーゼの会合及びPIP3産生の経時変化とCon A濃度依存性が一致し、どちらも百日咳毒素前処理によって影響を受けなかった。すなわち、Con A刺激によるPIP3産生は、チロシンリン酸化蛋白質とPI3-キナーゼの会合よりはむしろGiを介した経路によって活性化されるPI3-キナーゼによって引き起こされる可能性が示唆された。 Con AによるPIP3産生に依存した活性酸素産生の増大 細胞をCon Aで刺激すると、その濃度に依存して活性酸素産生が増大した。百日咳毒素またはwortmanninで細胞を前処理すると、Con A刺激によるO2-産生は著しく抑制された。O2-産生に対するCon Aの濃度依存性、百日咳毒素感受性及びwortmannin感受性は、Con A刺激によるPIP3産生の場合と極めて類似することから、Con AによるO2-産生にはPIP3を産生するPI3-キナーゼが関与することが示唆された。 走化性因子受容体を介するCon Aの作用 細胞を走化性因子のformyl Met-Leu-Phe(fMLP)で刺激しても、PIP3産生とO2-産生が認められる。そこで、fMLP受容体のアンタゴニストであるt-Boc-MLPを同時添加してCon Aの作用を検討した結果、PIP3産生とO2-産生は完全に抑制された。すなわち、Con Aの上記の作用はfMLP受容体を介して発現することが示唆された。 以上を要するに、本論文は食細胞をCon Aで刺激するとCblがチロシンリン酸化されてPI3-キナーゼと会合するが、細胞内でのPIP3産生には主にGiを介した経路によって活性化されたPI3-キナーゼが関与すること、さらにCon A刺激によるO2-産生は、fMLP受容体と共役したGiによるPI3-キナーゼの活性化の結果産生するPIP3を介して発現することを初めて示唆している。これらの成果は食細胞の活性化や炎症の機構解明、さらには細胞生理学の進展に有益な知見をもたらすものであり、博士(薬学)の学位論文として十分な価値のあるものと認められる。 |