種々の大きさのDNA反復配列は、哺乳類のゲノム中随所に見られ、個体により反復数が異なっている多型を示すことが知られている。近年、Huntington’s disease(HD)やspinocerebellar ataxia 1(SCA1)をはじめとするいくつかのヒト遺伝性神経疾患において、その原因遺伝子中の3塩基反復配列が正常範囲を逸脱し増幅していることが発病の原因であると判明し、新しいタイプの遺伝子異常として注目されている。これらの疾患はトリプレットリピート病と呼ばれ、現在までに少なくとも7つが知られている(Table1)。しかしながら、これらの異常増幅した3塩基反復配列がどのような機序によって神経疾患をもたらすのかについては明らかになっていない。HDやSCA1、dentatorubral-pallidoluysian atrophy(DRPLA)などは、原因遺伝子のコーディング領域内にAGCリピートの増加がみられる。興味深いことに、これらの疾患は現在わかっている限りでは全て神経変性疾患である。HD、SCA1、DRPLAなどの疾患の原因遺伝子産物が神経以外の組織、細胞に広く発現していることが知られているにもかかわらず神経細胞死という組織選択的な障害が共通に見られることから、神経細胞内にはAGCリピートの増加と細胞死を結ぶ特有な経路が存在すると考えられる。一方、Myotonic distrophyやfragile X syndromeでは異常増幅したAGCリピートあるいはGGCリピートが遺伝子中の非翻訳領域に存在している。これらの場合には、異常増幅した3塩基反復配列が遺伝子発現に影響を与えることが病気と関係していると考えられている。このように3塩基反復配列が遺伝子のコーディング領域ばかりでなく、非翻訳領域にみられる疾患もあることから、私は、増幅したリピートに結合して転写や翻訳、RNAの安定性、あるいはそれ以外の機序に影響を与えるような蛋白質が存在し、このような蛋白質が正常な調節を乱すことにより病気が発症するのではないか、と考えた。そこで私は、これらの3塩基反復配列の増幅が神経への症状を引き起こす機序を明らかにする手掛かりを得るため、AGCリピートに特異的に結合する蛋白質の検索を行った。  Table 1 ヒトトリプレットリピート病1.一本鎖AGCリピート結合活性の検出 Table 1 ヒトトリプレットリピート病1.一本鎖AGCリピート結合活性の検出 はじめに、ゲルシフト法により(AGC)13オリゴマーをプローブとして用い、成熟マウス脳抽出液中のAGCリピート結合活性を測定した。その結果、一本鎖AGCリピートに特異的に結合する活性が検出された。また二本鎖AGC/GCTリピート及びAGCの相補鎖である一本鎖GCTリピートに結合する活性はほとんど認められなかった。この一本鎖AGCリピート結合活性はマウス脳抽出液中に最も強く、肝臓、肺、心臓を含む他の組織抽出液中にはほとんど検出されなかった(Fig.1)。また一本鎖AGCリピート結合活性は胎児マウス脳抽出液中には見いだされなかった。 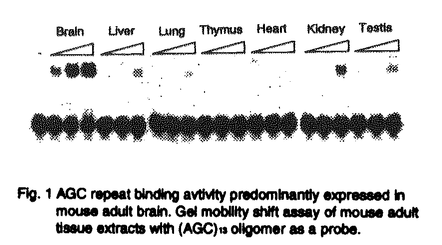 Fig.1 AGC repeat binding avtivity predominantly expressed in mouse adult brain.Gel mobillty shift assay of mouse adult tissue extracts with(AGC)13 ollgomer as a probe.2.一本鎖AGCリピート結合蛋白質TRIP-1、TRIP-2の精製 Fig.1 AGC repeat binding avtivity predominantly expressed in mouse adult brain.Gel mobillty shift assay of mouse adult tissue extracts with(AGC)13 ollgomer as a probe.2.一本鎖AGCリピート結合蛋白質TRIP-1、TRIP-2の精製 このAGCリピート結合活性を担う蛋白質を同定するため、(AGC)13オリゴマーへの結合活性を指標とし成熟マウス脳抽出液より精製を行った。AGCオリゴマーによるDNAアフィニティーカラム、Mono Sカラム、Mono Qカラムにより一本鎖(AGC)13リピート結合活性と挙動を共にする、分子量44kDaと40kDaの2つの蛋白質が精製された(Fig.2(A))。この2つの蛋白質は、精製の最終段階であるMono Qカラムによっても分離することが出来なかったことから、両者は非常に化学的性質の類似したものである可能性が高い。最終精製標品を用いたUV cross-linkingにより44kDa、40kDa蛋白質のそれぞれがAGCリピート結合活性をもつことが確認された。さらにこの2つの蛋白質は共に、トリプレットリピート病において増幅の見られるもうひとつの配列であるGGCリピートにも結合活性を示したが(Fig.2(B))、一方、病気とは関係のないACGやAAC、AGGなどの3塩基反復配列には結合しなかった。この44kDa、40kDaの特異的な3塩基反復配列に結合する蛋白質をそれぞれTRIP-1、TRIP-2と命名した(TRIP:trinucleotide repeat-binding protein)。また、これらがRNAに対しても結合活性をもつか否かをゲルシフト法により調べた。その結果、両者は一本鎖DNA-AGCリピートに対するほどの親和性は示さないものの、RNA-AGCリピートに対しても明らかに結合活性をもつことが示された。このことから、TRIPが細胞内でRNA結合蛋白質として機能している可能性も考えられた。 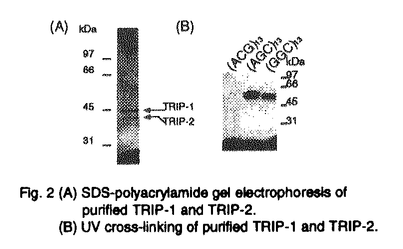 Fig.2(A)SDS-polyacrylamide gel electrophoresis of purified TRIP-1 and TRIP-2.(B)UV cross-linking of purified TRIP-1 and TRIP-2.3.TRIP-1、TRIP-2のcDNAクローニング Fig.2(A)SDS-polyacrylamide gel electrophoresis of purified TRIP-1 and TRIP-2.(B)UV cross-linking of purified TRIP-1 and TRIP-2.3.TRIP-1、TRIP-2のcDNAクローニング 精製したTRIP-1から部分アミノ酸配列を決定し、それをもとに合成したプライマーを用いて、成熟マウス脳mRNAを鋳型にRT-PCRを行った。増幅されたcDNA断片をプローブとし成熟マウス脳cDNAライブラリーをスクリーニングしたところ、TRIP-1をコードするcDNAのほかTRIP-2をコードをする新規のcDNAを得、その全塩基配列を決定した。その結果、TRIP-1とTRIP-2のアミノ酸配列はその全域にわたり非常に高い相同性を有していることがわっかた。このスクリーニングで得られた2種類のクローンがTRIP-1、TRIP-2をコードするcDNAに対応することは、それぞれのクローンの遺伝子組換え蛋白質の分子量と3塩基反復配列に対する結合特異性が、マウス脳より精製したnative蛋白質TRIP-1、TRIP-2のものと一致したことから確認された。 4.TRIP-1、TRIP-2mRNAの成熟に伴う脳組織特異的な発現 TRIP-1、TRIP-2のmRNAの発現量を調べるため、それぞれをコードするcDNAをプローブとし、成熟マウスの種々の組織を用いてノーザンブロットを行った。その結果、TRIP-1、TRIP-2の発現は共に脳に最も高く、他の組織中には非常に低いことが確認された。この結果は、組織粗抽出液中の一本鎖AGCリピート結合活性の結果と一致した。一方、ヒトトリプレットリピート病は成人になってから発症することが知られているので、生後のさまざまな段階のマウス脳組織からRNAを抽出し、RNase Protection法によって、TRIPのmRNAが生後どのような発現パターンを示すのか検討した。その結果、TRIP-1、TRIP-2のmRNAの発現は生後徐々に増加し3〜4週齢(young adult)でプラトーに達することが明らかとなり、TRIPの発現がヒトトリプレットリピート病の発症過程と相関するように見えた。 5.TRIP-1、TRIP-2の脳内での局在 マウス脳内でのTRIPの分布を細胞レベルで調べるため、成熟マウス脳切片を用いてin situ hybridizationを行った。海馬(hippocampus)、視床(thalamus)、淡蒼球(globus pallidus)などの調べた領域において、TRIP-1、TRIP-2は共に神経細胞に非常に高く発現し、一方、グリア細胞には弱い発現しか認められなかった(Fig.3)。さらに、TRIP-2に特異的な抗体を使った成熟マウス脳切片の免疫染色により、TRIP-2は神経細胞の細胞質に局在し、核には存在しないことが示された。以上の結果から、TRIPは脳神経細胞の細胞質で機能していることが示唆された。 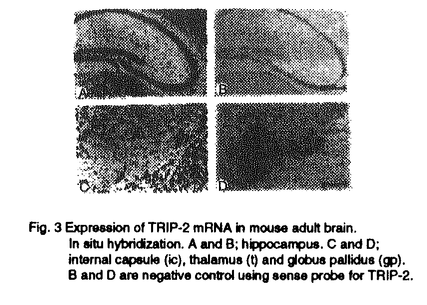 Fig.3 Expression of TRIP-2 mRNA in mouse adult brain.In situ hybridization.A and B;hippocampus.C and D;internal capsule(ic),thalamus(t)and globus pallidus(gp).B and D are negative control using sense probe for TRIP-2.まとめと考察 Fig.3 Expression of TRIP-2 mRNA in mouse adult brain.In situ hybridization.A and B;hippocampus.C and D;internal capsule(ic),thalamus(t)and globus pallidus(gp).B and D are negative control using sense probe for TRIP-2.まとめと考察 本研究により、以下のことが明らかとなった。(1)成熟マウス脳抽出液中には、AGCやGGCリピートなどの一本鎖3塩基反復配列に特異的に結合する2種類の蛋白質、TRIP-1(44kDa)とTRIP-2(40kDa)が存在する。(2)TRIPはin vitroでRNA-AGCリピートに結合する。(3)成熟マウスにおけるTRIP-1、TRIP-2の発現は脳神経細胞に最も高く、他の組織では非常に低い。また、TRIP-1、TRIP-2の脳における発現は胎児には見られず、生後成熟に伴って徐々に増加しyoung adultでプラトーに達する。(4)TRIP-2は神経細胞内の核ではなく、細胞質に局在している。 TRIPの発現の特徴は、ヒトのトリプレットリピート病症状の特徴、即ち神経細胞の障害及び成人になってからの発症と類似していた。本研究の結果から、TRIPが増幅した3塩基反復配列をもつmRNAへの結合を介してトリプレットリピート病に見られる神経症状に関与している可能性も考えられる。この際、TRIPがmRNAの翻訳や安定性に影響を与える可能性も考えられるが、具体的にどのような機序により病気の発症に関与するのかは今後の課題である。3塩基反復配列の異常増幅が神経細胞に障害を与える機序を解明する上で、神経細胞に特異的に発現する3塩基反復配列結合蛋白質TRIPは重要な手掛かりになると思われる。 |