| 内容要旨 | | 【序】トウトマイセチン(tautomycetin)1は、80年代ごろ理研の磯野らの研究グループによって、中国産の放線菌Streptomyces griseochromogenesから単離された真核菌に対する強い毒性を持つ化合物である1。また最近大阪大学の山田らのグループの研究により、このトウトマイセチンが放線菌Penicillium urticaeの二次代謝産物の生産を活性化することも報告された。同様の活性がオカダ酸クラスの発癌プロモーターで、強力なプロティンホスファターゼ阻害剤として知られるトウトマイシンにも認められ、しかも、トウトマイセイチンの方がその作用が3倍程度強い事が示された2。この事は、トウトマイセチンが類似の構造を有するトウトマイシンと同様に強力なホスファターゼ阻害剤である可能性を示唆しており、その詳しい生物活性の研究は未知の発癌機構の解明に有用なバイオロジカルツールを提供するものと期待される。しかしこのトウトマイセチンは天然から微量しか得ることができず、しかも非常に不安定な化合物であるため、その構造活性相関を含めた詳し生物活性の解明のためには全合成による供給が必須である。そこで私は絶対配置の決定を含めた全合成ひいては生物活性研究への発展を目標に研究を開始した。 【合成計画】トウトマイセチンは8つの不斉中心と特徴的なジエノン構造を持つ鎖状分子である。しかし、その化学的な不安定性のため平面構造しか決定されておらず、無水マレイン酸部分を除く7つの不斉中心の立体化学は未決定であった。そこで、まずトウトマイセチンの分解産物として報告されたC1からC18までに相当するフラグメントに着目し、この化合物を合成することにより、7つの不斉中心の立体化学を決定することを計画した。実際の戦略としては、Scheme1に示すように、6つの不斉炭素を3つのグループC7,C9;C12,C13;C17,C18に分け、すべての可能な立体異性体の合成に適用しうる合成ルートを考えた。即ちC7,C9とC17,C18に相当する4a-dと5a-dのような立体化学制御合成が可能な既知化合物をビルディングブロックとして両端から合成を行うことにした。またC13,C14の立体化学はEvansのアルドール反応を用いればその立体化学を制御し、選択的に合成することができると考えた。更に、C12の立体化学はC14位の水酸基関与により制御することができると考えた。以上の考え方に従って、まず、トウトマイシンの立体化学を参考とし、7R,9R,12S,13S,17S,18Rの化合物を最初のターゲートとして合成を行った。初めて合成に成功したこの化合物を天然物の分解産物3のスペクトルと詳しく比べた結果、その1H-NMR上でのC6,C13,C16に相当するプロトンのケミカルシフトに大きな差異がみられることが判明した。そこで、更にいくつかの立体異性体の合成を行い、1H-NMRの詳細な検討を行った結果C7,C9及びC12,C13の相対配置は共にanti、C17,C18の相対配置はsynの時のスペクトルデータが天然物と近いことが判明した。このC7,C9anti、C12,C13anti、C17,C18synの相対配置を持つジアステレオマーは4種の可能性が考えられるため、結局この4つのジアステレオマーすべてを含む合計14の立体異性体を合成し、スペクトルデータの詳細な比較を行った結果、7R,9S,12S,13S,17S,18Rの配置を持つ異性体のすべてのスペクトルデータが天然物の分解産物と完全に一致した。この事により未決定であったトウトマイセチンの6つの立体配置を決定する事に成功した3。 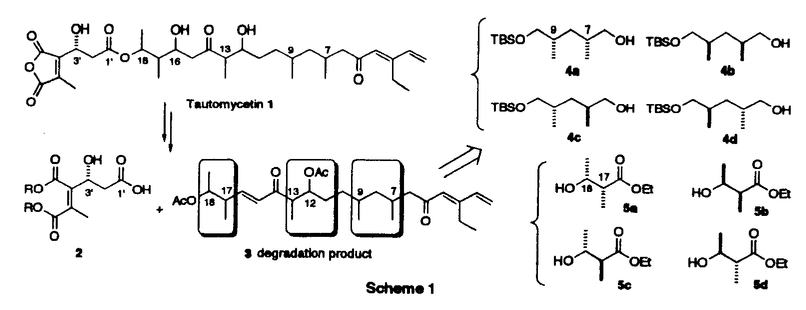 Scheme 1 Scheme 1 尚、具体的な合成方法は、Scheme2に示す。例として化合物3の合成方法を示したが、他の異性体の合成も前述異なる出発物から、類似の方法で合成を行った。即ちまず、ジエナール6は、銅試薬の付加反応により立体選択的に合成し、7とカップリングすると、目的とする8が5位のエピマーの混合物として得られた。以後の合成中間体化合物のスペクトルが複雑になるのを避けるため、この段階でこのエピマー混合物を分離し、とりあえず8aのみを用いて先の反応へ進んだ。一方、左側部分の合成は、5aから得られたアルデヒド10をEvansの方法を利用し、光学活性オキサゾリジノン11と縮合する事によりC13,14位の立体化学を制御し達成することができた。更に、Horner-Emmons反応のためのホスホネートに導き、右側のフラグメントとつないで、ケトン15,16を得た。次に、カルボニルを還元し、得られたアルコール体17をジオール体18に導き、この段階でエピマーを分けることができた。最後にDess-Martin酸化反応を行い、目的の天然物の分解産物と一致する化合物3の合成に成功した。 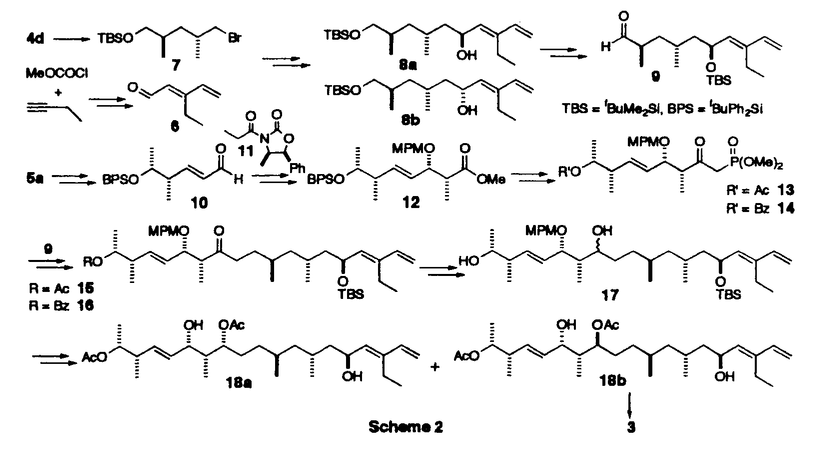 Scheme 2 Scheme 2 【全合成】上に述べたように3の合成によりトウトマイセチンの16位以外の立体化学を決定する事ができたので、次に効率的な全合成に着手した。16位の立体配置はトウトマイシンの立体化学を参考とし、まずRに設定し、1,6-Anhydro- -D-glucoseを出発原料として合成を開始した。2位の水酸基を還元的に除いた後、4位の水酸基も立体選択的にメチル基に変換した。更に1,6位を開環してから還元し、10工程で効率的にトウトマイセチンの16、17、18位に対応する望ましい立体化学を持つジチアン化合物に導いた。以後の合成は前に述べたトウトマイセチン分解産物の合成と類似の方法を用いて、まず、7位が異なる立体化学を有する4aを用い、モデル反応を行った結果、12工程でケトン22の合成に成功した。現在保護基の検討も含め、トウトマイセチン1の全合成を検討中である。 -D-glucoseを出発原料として合成を開始した。2位の水酸基を還元的に除いた後、4位の水酸基も立体選択的にメチル基に変換した。更に1,6位を開環してから還元し、10工程で効率的にトウトマイセチンの16、17、18位に対応する望ましい立体化学を持つジチアン化合物に導いた。以後の合成は前に述べたトウトマイセチン分解産物の合成と類似の方法を用いて、まず、7位が異なる立体化学を有する4aを用い、モデル反応を行った結果、12工程でケトン22の合成に成功した。現在保護基の検討も含め、トウトマイセチン1の全合成を検討中である。 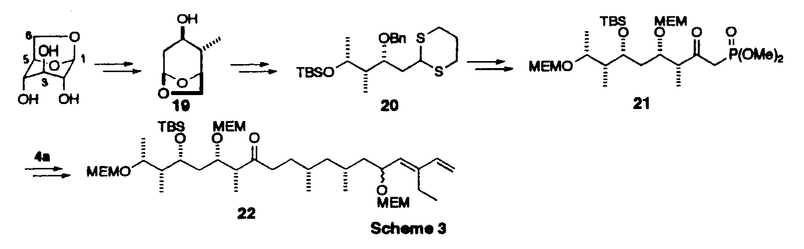 Scheme 3 Scheme 3 【まとめ】以上述べてきたように、非常に不安定な天然物であるトウトマイセチンの、通常の分析手段で解決困難であった立体化学の解明に成功した。またトウトマイセイチンの全合成研究においても基本的な骨格の構築の方法を完成し、無水マレイン酸とのカップリングと保護基の問題が解決すれば全合成の達成が可能であると考えている。更に、これらの研究成果は、生物活性に興味が持たれる種々のトウトマイセチン誘導体合成への有効な手段を提供しうるものと期待している。 References and Notes (1)Chen,X.-C.;Ubukata,M.;Isono,K.J.Antibiotics 1990,43,890 (2)(a)Chen,X.-C.;Ubukata,M.;Isono,K.J.Antibiotics.1990,43,809.(b)Sakuda,S.;Miki,K.;Kitaoka,S.;Reugjitchachawaly,M.;Yamada,Y.Biosci.Biotech.Biochem.1995,59,133. 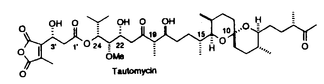 (3)Jian-PingDai,MikikoSodeoka,and MasakatsuShibasaki.TetrahedronLett.in press. |
| 審査要旨 | | トウトマイセチン(tautomycetin)1は、80年代ごろ理研の磯野らの研究グループによって、中国産の放線菌Streptomyces griseochromogenesから単離された真核菌に対する強い毒性を持つ化合物である。また最近大阪大学の山田らのグループの研究により、このトウトマイセチンが放線菌Penicillium urticaeの二次代謝産物の生産を活性化することも報告された。同様の活性がオカダ酸クラスの発癌プロモーターで、強力なプロティンホスファターゼ阻害剤として知られるトウトマイシンにも認められ、しかも、トウトマイセイチンの方がその作用が3倍程度強い事が示された。この事は、トウトマイセチンが類似の構造を有するトウトマイシンと同様に強力なホスファターゼ阻害剤である可能性を示唆しており、その詳しい生物活性の研究は未知の発癌機構の解明に有用なバイオロジカルツールを提供するものと期待される。しかしこのトウトマイセチンは天然から微量しか得ることができず、しかも非常に不安定な化合物であるため、その構造活性相関を含めた詳し生物活性の解明のためには全合成による供給が必須である。このような背景から、戴剣平は絶対配置の決定を含めた全合成ひいては生物活性研究への発展を目標に研究を開始した。 トウトマイセチンは8つの不斉中心と特徴的なジエノン構造を持つ鎖状分子である。しかし、その化学的な不安定性のため平面構造しか決定されておらず、無水マレイン酸部分を除く7つの不斉中心の立体化学は未決定であった。そこで、まずトウトマイセチンの分解産物として報告されたC1からC18までに相当するフラグメントに着目し、この化合物を合成することにより、7つの不斉中心の立体化学を決定することを計画した。実際の戦略としては、Scheme 1に示すように、6つの不斉炭素を3つのグループC7,C9;C12,C13;C17,C18に分け、すべての可能な立体異性体の合成に適用しうる合成ルートを考えた。即ちC7,C9とC17,C18に相当する4a-dと5a-dのような立体化学制御合成が可能な既知化合物をビルディングブロックとして両端から合成を行うことにした。またC13,C14の立体化学はEvansのアルドール反応を用いればその立体化学を制御し、選択的に合成することができると考えた。更に、C12の立体化学はC14位の水酸基関与により制御することができると考えた。以上の考え方に従って、まず、トウトマイシンの立体化学を参考とし、7R,9R,12S,13S,17S,18Rの化合物を最初のターゲットとして合成を行った。初めて合成に成功したこの化合物を天然物の分解産物3のスペクトルと詳しく比べた結果、その1H-NMR上でのC6,C13,C16に相当するプロトンのケミカルシフトに大きな差異がみられることが判明した。そこで、更にいくつかの立体異性体の合成を行い、1H-NMRの詳細な検討を行った結果C7,C9及びC12,C13の相対配置は共にanti、C17,C18の相対配置はsynの時のスペクトルデータが天然物と近いことが判明した。このC7,C9anti、C12,C13anti、C17,C18synの相対配置を持つジアステレオマーは4種の可能性が考えられるため、結局この4つのジアステンオマーすべてを含む合計14の立体異性体を合成し、スペクトルデータの詳細な比較を行った結果、7R,9S,12S,13S,17S,18Rの配置を持つ異性体のすべてめスペクトルデータが天然物の分解産物と完全に一致した。この事により未決定であったトウトマイセチンの6つの立体配置を決定する事に成功した。 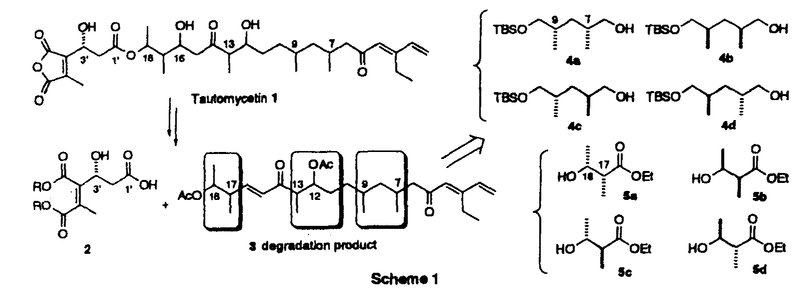 Scheme 1 Scheme 1 尚、具体的な合成方法は、Scheme 2に示す。 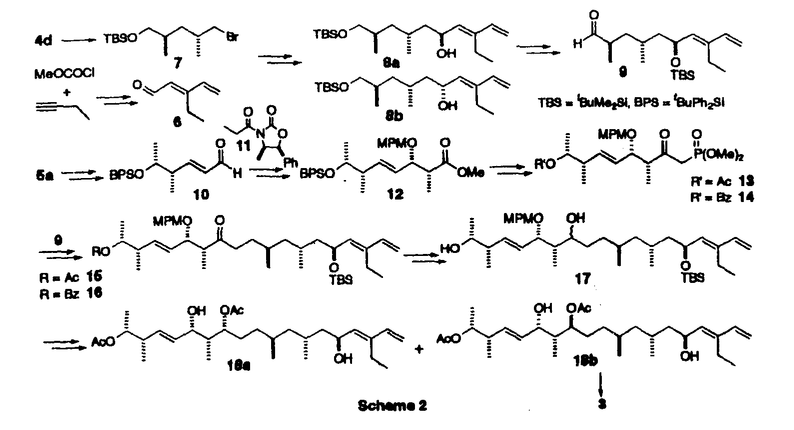 Scheme 2 Scheme 2 以上、本論文は生物学的に重要なトウトマイセチンの構造決定及び全合成アプローチに関する物であり、ここに記された結果は今後の生命科学研究に多大な貢献をすることが期待される。よって博士(薬学)を与えるに十分な研究成果であると判断した。 |