1個の卵が多様な細胞に分化することで個体は形成される。個々の細胞はそれぞれ固有の機能を果たし、適切な時、場所で増殖、分化することで生物の生命を維持している。そして細胞の増殖と分化は細胞内に張り巡らされたシグナル伝達網が秩序を保ち機能することで制御される。なかでもリン酸化による蛋白の活性制御は、シグナル伝達系において中心的役割を担う制御機構である。プロテインキナーゼC(PKC)は脂質、カルシウム、ジアシルグリセロール(DG)により活性化される蛋白リン酸化酵素として発見された。その後の分子生物学的アプローチにより現在11種類に及ぶ遺伝子群の存在が確認され、分子構造と酵素学的性質から1)Ca2+依存性classical PKC(cPKC),2)Ca2+非依存性novel PKC(nPKC),3)Ca2+,DG非依存性atypical PKC(aPKC)の3つのサブファミリーに分類されている。各PKC分子種は組織普遍的もしくは特異的発現を示し、異なる活性化様式を持つことから、個々の分子種がそれぞれの組織、細胞で独自の機能を果たしているものと推測されている。 我々がマウス皮膚cDNAライブラリーより単離した 分子種(eta,nPKC 分子種(eta,nPKC )は、上皮特異的発現を示すこと、また分化の進んだ層に高い発現を示す傾向があることから上皮細胞の分化に関与する可能性が示唆されている。そこでnPKC )は、上皮特異的発現を示すこと、また分化の進んだ層に高い発現を示す傾向があることから上皮細胞の分化に関与する可能性が示唆されている。そこでnPKC の上皮細胞における機能を解明するため、分化能を持つ培養正常表皮ケラチノサイトにnPKC の上皮細胞における機能を解明するため、分化能を持つ培養正常表皮ケラチノサイトにnPKC を導入、過剰発現させ細胞増殖と分化マーカーの発現を中心に解析を行った。さらにnPKC を導入、過剰発現させ細胞増殖と分化マーカーの発現を中心に解析を行った。さらにnPKC 導入トランスジェニックマウスを作製し個体レベルでの影響を検討した。 導入トランスジェニックマウスを作製し個体レベルでの影響を検討した。 1.アデノウイルスベクターによるPK遺伝子の導入 ヒト正常表皮ケラチノサイト(NHK)は包皮及び胸部手術余剰片より初代培養し、2〜4継代目の細胞を用いた。しかしながらNHKに遺伝子導入を行う際、以下の問題が生じた。第一にNHKの継代数は最大でも4〜6が限度でありstable transformantを得ることが不可能であること、またリン酸カルシウム等の物理的導入法を用いた場合、遺伝子導入効率が0.001〜0.1%程度と極めて低いため、transient expressionによる解析が困難であることの2点である。そこであらゆる細胞にほぼ100%の効率で遺伝子導入が可能な非増殖型アデノウイルスベクターを用いることとし、表皮での主要な構成PKC分子種cPKC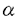 ,nPKC ,nPKC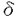 ,nPKC ,nPKC 及びaPKC 及びaPKC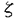 の全長cDNAを挿入したAd5型アデノウイルスベクターを構築した。発現ユニットとして、サイトメガロウイルスIEプロモーター及び の全長cDNAを挿入したAd5型アデノウイルスベクターを構築した。発現ユニットとして、サイトメガロウイルスIEプロモーター及び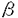 -アクチンプロモーターを連結したCAプロモーターを用いた。 -アクチンプロモーターを連結したCAプロモーターを用いた。 ウエスタンプロットにより感染後6時間から導入蛋白の発現上昇が確認され、24時間でピークに達し60時間まで維持された後、72時間で30%程度減少した。また細胞染色により、ほぼすべての細胞で過剰発現されることが確認された。更にPKCの自己リン酸化能及び導入細胞の部分精製品を用いた活性測定により、重複感染度(m.o.i.)に依存して活性化能が上昇することが確認された。 2.形態変化及び細胞増殖 NHKにnPKC の導入後24〜36時間で小型で敷石状の形態が扁平巨大化し、細胞間の境界が不明瞭となり形態的に分化した。またnPKC の導入後24〜36時間で小型で敷石状の形態が扁平巨大化し、細胞間の境界が不明瞭となり形態的に分化した。またnPKC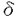 によっても扁平化の傾向を示したが、より紡錘状の形態が認められた。一方、cPKC によっても扁平化の傾向を示したが、より紡錘状の形態が認められた。一方、cPKC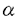 ,aPKC ,aPKC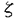 の過剰発現によっては上記の変化は全く生じなかった。 の過剰発現によっては上記の変化は全く生じなかった。 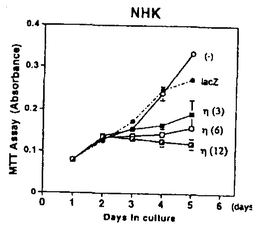 図表 図表 表皮ケラチノサイトは、分化に伴いその増殖を停止する。そこでMTT法及びBrdUの取り込みにより細胞増殖に及ぼす影響を検討したところ、nPKC により著しい増殖抑制が認められDNA合成は48時間後に10%以下にまで抑えられた。同様にnPKC により著しい増殖抑制が認められDNA合成は48時間後に10%以下にまで抑えられた。同様にnPKC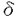 によってもNHKは増殖阻害されたが、cPKC によってもNHKは増殖阻害されたが、cPKC ,aPKC ,aPKC は影響を及ぼさなかった。 は影響を及ぼさなかった。 またnPKC によりマウスケラチノサイトBalbMK2の増殖は、12-O-tetradecanoylphorbol-13-acetate(TPA)の存在下で著しく抑制された。一方、 によりマウスケラチノサイトBalbMK2の増殖は、12-O-tetradecanoylphorbol-13-acetate(TPA)の存在下で著しく抑制された。一方、 分子種の発現が認められないヒト正常線維芽細胞、マウス線維芽細胞株Balb3T3及びCOS1細胞においては、増殖抑制は全く認められなかった。 分子種の発現が認められないヒト正常線維芽細胞、マウス線維芽細胞株Balb3T3及びCOS1細胞においては、増殖抑制は全く認められなかった。  図表 図表 以上のことからnPKC による増殖抑制能は、ケラチノサイト特異的現象である可能性が示された。またヨウ化プロピジウムとFACScanによる細胞周期の解析からG1期で停止していることが確認された。 による増殖抑制能は、ケラチノサイト特異的現象である可能性が示された。またヨウ化プロピジウムとFACScanによる細胞周期の解析からG1期で停止していることが確認された。 3.Type1-Transglutaminaseの発現と酵素活性 ケラチノサイトの最終分化マーカー、Type1-Transglutaminase(TG1)の酵素活性が 分子種の発現に伴い上昇、48時間後に約2倍となった。またこの活性上昇はm.o.i依存的増加を示した。 分子種の発現に伴い上昇、48時間後に約2倍となった。またこの活性上昇はm.o.i依存的増加を示した。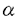 、 、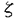 分子種によっては全く活性上昇が見られず、同時にTPAを添加してもTPA単独処理と同じレベルであった。さらに分化誘導因子のCa2+、活性型ビタミンD3によるTG1活性の増加は、ATP結合領域に変異を導入したDominant Negative Type PKC 分子種によっては全く活性上昇が見られず、同時にTPAを添加してもTPA単独処理と同じレベルであった。さらに分化誘導因子のCa2+、活性型ビタミンD3によるTG1活性の増加は、ATP結合領域に変異を導入したDominant Negative Type PKC の過剰発現により著しく抑制された。また他の分化マーカーとして中間形フィラメントKeratin1、Conified Envelope構成成分Loricrinの発現をノーザンプロットにより検討したが、顕著な誘導は認められなかった。以上のことからnPKC の過剰発現により著しく抑制された。また他の分化マーカーとして中間形フィラメントKeratin1、Conified Envelope構成成分Loricrinの発現をノーザンプロットにより検討したが、顕著な誘導は認められなかった。以上のことからnPKC はケラチノサイトの分化過程のうち、Type1-Transglutaminaseの活性上昇に関与していることが示された。 はケラチノサイトの分化過程のうち、Type1-Transglutaminaseの活性上昇に関与していることが示された。 4.nPKC トランスジェニックマウスの作製と解析 トランスジェニックマウスの作製と解析 個体レベルでnPKC の機能を解析するためにnPKC の機能を解析するためにnPKC 導入トランスジェニックマウスを作製した。皮膚は、最下層から順に増殖の盛んな基底層、分化し増殖の停止した有棘層、更に上層の顆粒層、角化層により形成される。皮膚の分化した領域、即ち有棘層、顆粒層のみに高発現させる目的でTarget Expressionの手法を用いた。ヒトインボルクリンプロモーターの下流にnPKC 導入トランスジェニックマウスを作製した。皮膚は、最下層から順に増殖の盛んな基底層、分化し増殖の停止した有棘層、更に上層の顆粒層、角化層により形成される。皮膚の分化した領域、即ち有棘層、顆粒層のみに高発現させる目的でTarget Expressionの手法を用いた。ヒトインボルクリンプロモーターの下流にnPKC cDNAを挿入したコンストラクトを作製し、C3H/HeNマウスを用い定法により導入した。8匹のnPKC cDNAを挿入したコンストラクトを作製し、C3H/HeNマウスを用い定法により導入した。8匹のnPKC 導入マウスが得られ、以下の異常表現型を示した。 導入マウスが得られ、以下の異常表現型を示した。 1)尾の皮膚の乾燥粗造化、剥離、落屑及びひび割れ状の形態等の角化増大所見、皮膚疾患魚鱗せん:ichthyosis様所見 2)背部、脚体毛の減少、乾燥化傾向、3)背部皮膚の剥離、紅化、3)体長、体重の低下(正常比60〜95%:生後4週齢)4)衰弱化傾向 とりわけ激しい表現形を示したマウスの尾の皮膚をヘマトキシリンーエオジン染色し、組織像を比較したところ、皮膚上皮の肥厚化が認められ、また一部に脱核不全である不全角化が見られた。更に毛根の未発達による毛形成の不全、皮脂腺の発達異常が認められた。 次にそれぞれの層を特異的に認識する分化マーカーにより免疫組織染色を行った。有棘層及び顆粒層を認識するKeratin1、10、顆粒層を特異的に認識するLoricrinの染色部位には大きな違いは存在しなかったが、発現はやや減少していた。本来、基底層から有棘層への移行においてKeratin5、14からKeratin1、10への発現パターンの切り換えは極めて正確に制御されている。予期に反して、基底層のみに存在するKeratin14がnPKc 導入マウスにおいて、基底層のみならず有棘層、顆粒層にまで存在した。さらに電子顕微鏡による解析から、角化層の形成促進にもかかわらずtonofilamentの形成阻害、不十分な細胞間接着等も見いだされた。従って上の結果は分化過程の一部が異常に高進したことを示唆している。 導入マウスにおいて、基底層のみならず有棘層、顆粒層にまで存在した。さらに電子顕微鏡による解析から、角化層の形成促進にもかかわらずtonofilamentの形成阻害、不十分な細胞間接着等も見いだされた。従って上の結果は分化過程の一部が異常に高進したことを示唆している。 妊娠可能な4匹のF0マウスより得られたF1マウスにも全く同様な表現型が認められた。生後間もなくから皮膚は剥離し始め、生後7日目までにでさらに剥離は顕著となった。また正常マウスに比べ毛の発生の2〜4日の遅延が認められた。 また変異型nPKC 導入マウスでは、逆に顆粒層の堆積がみられ、nPKC 導入マウスでは、逆に顆粒層の堆積がみられ、nPKC が表皮分化、特に顆粒層から角化層への移行に関与していることがさらに示唆された。 が表皮分化、特に顆粒層から角化層への移行に関与していることがさらに示唆された。 まとめ 培養細胞、マウスを用いた検討からvitro,そしてvivoにおいてもnPKC は上皮分化のプロセスを促進する可能性が示された。分化過程のうち特に細胞増殖抑制、Transglutaminaseの活性上昇、顆粒層から角化層への移行の部分を担っていることも示唆された。これがnPKC は上皮分化のプロセスを促進する可能性が示された。分化過程のうち特に細胞増殖抑制、Transglutaminaseの活性上昇、顆粒層から角化層への移行の部分を担っていることも示唆された。これがnPKC 導入マウスにおける角化異常につながると考えられる。今後は、nPKC 導入マウスにおける角化異常につながると考えられる。今後は、nPKC の下流にある標的分子の検索、シグナル伝達機構の解析が重要といえる。 の下流にある標的分子の検索、シグナル伝達機構の解析が重要といえる。 |