一般にAsn型糖鎖では、分岐構造を形成するN-アセチルグルコサミン(GlcNAc)残基にガラクトース(Gal)が結合し、さらにシアル酸やフコースが結合して生物学的機能を有する多様な側鎖構造を形成している。最近、このガラクトースの代わりにN-アセチルガラクトサミン(GalNAc)が結合したGalNAc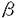 1→4GlcNAcという構造をもつ糖鎖が、下垂体の糖タンパク質ホルモンなどのごく限られた糖タンパク質に見いだされている。この稀な構造を作り出す原因として、ウシ下垂体のN-アセチルガラクトサミン転移酵素(GalNAcT)は、糖結合可能Asn残基近傍のPro-X-Arg/Lys配列を認識して糖を転移するという、ペプチド特異的な糖転移酵素であることが報告されている。 1→4GlcNAcという構造をもつ糖鎖が、下垂体の糖タンパク質ホルモンなどのごく限られた糖タンパク質に見いだされている。この稀な構造を作り出す原因として、ウシ下垂体のN-アセチルガラクトサミン転移酵素(GalNAcT)は、糖結合可能Asn残基近傍のPro-X-Arg/Lys配列を認識して糖を転移するという、ペプチド特異的な糖転移酵素であることが報告されている。 乳汁中に分泌される脂肪球は、トリアシルグリセロールをコアとし、そのまわりを乳腺上皮細胞の頂部細胞膜に由来する膜で覆われている。この膜をミルク脂肪球膜(milk fat globule membrane,MFGM)といい、頂部細胞膜に由来するタンパク質が濃縮されている。我々は、このMFGMの構成糖タンパク質の1つであるCD36の糖鎖構造を解析し、Gal残基の代わりにGalNAcが結合した極めて稀なGalNAc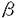 1→4GlcNAc構造をもつ糖鎖を見いだした。 1→4GlcNAc構造をもつ糖鎖を見いだした。 ウシMFGMを構成する糖タンパク質は十数種類存在するが、CD36以外の糖タンパク質糖鎖にもGalNAc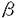 1→4GlcNAc構造が存在するかどうか、糖タンパク質をSDS-ポリアクリルアミドゲル電気泳動後ウエスタンブロットを行い、シアリダーゼ処理後、GalNAc残基を認識するフジマメレクチン(Wistaria floribunda agglutinin,WFA)を用いて解析した。その結果、ウシMFGMではCBBで染色されるタンパク質のほとんどがWFAと結合し、特にCD36、PASIII、ブチロフィリンで強い結合が見られた。WFAとの結合性は、糖タンパク質からAsn型糖鎖を遊離するN-グリカナーゼや、 1→4GlcNAc構造が存在するかどうか、糖タンパク質をSDS-ポリアクリルアミドゲル電気泳動後ウエスタンブロットを行い、シアリダーゼ処理後、GalNAc残基を認識するフジマメレクチン(Wistaria floribunda agglutinin,WFA)を用いて解析した。その結果、ウシMFGMではCBBで染色されるタンパク質のほとんどがWFAと結合し、特にCD36、PASIII、ブチロフィリンで強い結合が見られた。WFAとの結合性は、糖タンパク質からAsn型糖鎖を遊離するN-グリカナーゼや、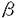 結合したGalNAc残基を切断するナタマメの 結合したGalNAc残基を切断するナタマメの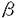 -N-アセチルヘキソサミニダーゼで処理すると完全に消失することから、GalNAc残基はAsn型糖鎖に存在し、CD36以外の糖タンパク質にもGalNAc -N-アセチルヘキソサミニダーゼで処理すると完全に消失することから、GalNAc残基はAsn型糖鎖に存在し、CD36以外の糖タンパク質にもGalNAc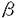 1→4GlcNAc構造をもつ糖鎖の存在が示唆された。 1→4GlcNAc構造をもつ糖鎖の存在が示唆された。 さらにレクチンブロット解析の結果を確認するために、ウシMFGM糖タンパク質からヒドラジン分解によりAsn型糖鎖を定量的に遊離し、N-アセチル化後NaB3H4で還元し[3H]-標識少糖を得た。[3H]-標識少糖を高圧ろ紙電気泳動により中性糖鎖と酸性糖鎖とに分け、酸性糖鎖はシアリダーゼで中性化した。これらの糖鎖を系統的レクチンカラムクロマトグラフィーで分画し、Bio-GelP-4を用いたゲルろ過カラムクロマトグラフィーと各種のエキソグリコシダーゼによる逐次消化を組み合わせて糖鎖構造を推定し、メチル化分析により糖鎖構造を決定した。その結果、ウシMFGM糖タンパク質糖鎖のうちWFA-agaroseカラムに結合するのは全糖鎖の28.5%で、いずれもGalNAc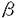 1→4GlcNAc構造をもつ混成型糖鎖、複合型2本鎖、2,6分岐3本鎖、4本鎖であることが判明した。 1→4GlcNAc構造をもつ混成型糖鎖、複合型2本鎖、2,6分岐3本鎖、4本鎖であることが判明した。 次にこの稀な糖タンパク質糖鎖の発現調節機構を調べる一環として、この二糖構造の発現と乳腺上皮細胞の機能分化の関係を解析した。乳汁分泌の初期では、MFGM糖タンパク質においてGalNAc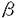 1→4GlcNAc構造の糖鎖をもつタンパク質が増加することから、乳汁分泌過程で糖タンパク質糖鎖のN-アセチルガラクトサミニル化が変化していると考えられた。そこで泌乳期および退縮したウシ乳腺組織を用い、糖タンパク質糖鎖におけるGalNAc 1→4GlcNAc構造の糖鎖をもつタンパク質が増加することから、乳汁分泌過程で糖タンパク質糖鎖のN-アセチルガラクトサミニル化が変化していると考えられた。そこで泌乳期および退縮したウシ乳腺組織を用い、糖タンパク質糖鎖におけるGalNAc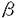 1→4GlcNAc構造の発現分布をWFAを用いたレクチンブロットにより解析した。その結果、泌乳期の乳腺組織ではCBBで染色されるタンパク質の多くがWFAと結合するのに対して、退縮した乳腺組織ではWFAと結合する糖タンパク質の数が激減していた。一方、ウシ乳腺から樹立した初代培養上皮細胞の細胞膜糖タンパク質糖鎖を解析すると、WFAと結合する糖鎖は全く存在していなかった。この培養細胞では培養上清中にカゼインが検出されず、細胞は泌乳期の機能を失っていると考えられた。そこで細胞の機能分化を誘導させるため、初代培養細胞をコラーゲン上でホルモンの混合物(プロラクチン,インスリン,ヒドロコーチゾン)存在下で培養した。その結果、この細胞は培養上清中に脂肪球やカゼインを分泌するようになり、かつGalNAc 1→4GlcNAc構造の発現分布をWFAを用いたレクチンブロットにより解析した。その結果、泌乳期の乳腺組織ではCBBで染色されるタンパク質の多くがWFAと結合するのに対して、退縮した乳腺組織ではWFAと結合する糖タンパク質の数が激減していた。一方、ウシ乳腺から樹立した初代培養上皮細胞の細胞膜糖タンパク質糖鎖を解析すると、WFAと結合する糖鎖は全く存在していなかった。この培養細胞では培養上清中にカゼインが検出されず、細胞は泌乳期の機能を失っていると考えられた。そこで細胞の機能分化を誘導させるため、初代培養細胞をコラーゲン上でホルモンの混合物(プロラクチン,インスリン,ヒドロコーチゾン)存在下で培養した。その結果、この細胞は培養上清中に脂肪球やカゼインを分泌するようになり、かつGalNAc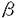 1→4GlcNAc構造をもつ糖鎖が幾つかの糖タンパク質で発現しているのが見られた。以上の所見から、ウシ乳腺組織では糖タンパク質糖鎖のN-アセチルガラクトサミニル化の消長はホルモンによる調節制御を受け、細胞の機能分化と密接に相関していると考えられた。 1→4GlcNAc構造をもつ糖鎖が幾つかの糖タンパク質で発現しているのが見られた。以上の所見から、ウシ乳腺組織では糖タンパク質糖鎖のN-アセチルガラクトサミニル化の消長はホルモンによる調節制御を受け、細胞の機能分化と密接に相関していると考えられた。 ウシ下垂体の糖タンパク質ホルモンに見られる糖鎖のN-アセチルガラクトサミニル化は、糖鎖結合部位近傍のPro-X-Arg/Ly配列で制御されている可能性が報告されている。ウシ・ブチロフィリンはGalNAc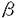 1→4GlcNAc構造をもつ糖鎖を含み、かつMFGMタンパク質の中で唯一全アミノ酸配列が明らかにされている。そこでこの糖タンパク質から3つの糖結合可能Asn残基を含むペプチドを調製し、糖鎖のN-アセチルガラクトサミニル化とPro-X-Arg/Lys配列の相関を調べた。ブチロフィリンをAchromo-bacter protease Iで消化後、逆相HPLCにより3つの糖結合可能Asn残基を含むペプチドを分離した。それぞれの糖ペプチドをヒドラジンで処理すると、Asn-55とAsn-215を含むペプチドから糖鎖が遊離した。それぞれの糖鎖構造を解析すると、Asn-55に結合していた糖鎖の約50%がGalNAc 1→4GlcNAc構造をもつ糖鎖を含み、かつMFGMタンパク質の中で唯一全アミノ酸配列が明らかにされている。そこでこの糖タンパク質から3つの糖結合可能Asn残基を含むペプチドを調製し、糖鎖のN-アセチルガラクトサミニル化とPro-X-Arg/Lys配列の相関を調べた。ブチロフィリンをAchromo-bacter protease Iで消化後、逆相HPLCにより3つの糖結合可能Asn残基を含むペプチドを分離した。それぞれの糖ペプチドをヒドラジンで処理すると、Asn-55とAsn-215を含むペプチドから糖鎖が遊離した。それぞれの糖鎖構造を解析すると、Asn-55に結合していた糖鎖の約50%がGalNAc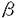 1→4GlcNAc構造をもち、Asn-215に結合していた糖鎖ではこの二糖構造は見いだされなかった。Asn-55より3アミノ酸残基N末端側にPro-Cys-Arg配列があり、このペプチド配列が部位特異的な糖鎖のN-アセチルガラクトサミニル化に影響を与えている可能性が考えられた。 1→4GlcNAc構造をもち、Asn-215に結合していた糖鎖ではこの二糖構造は見いだされなかった。Asn-55より3アミノ酸残基N末端側にPro-Cys-Arg配列があり、このペプチド配列が部位特異的な糖鎖のN-アセチルガラクトサミニル化に影響を与えている可能性が考えられた。 この可能性を調べるため、Pro-Leu-Arg配列をもち下垂体の糖タンパク質ホルモンと同じファミリーに属するヒト絨毛性性腺刺激ホルモンとこの配列をもたないヒトトランスフェリンをシアリダーゼとガラクトシダーゼで処理してGlcNAc残基を末端にもつ糖受容体を作製した。ウシ乳腺組織細胞のミクロソーム画分を酵素源として、作製した糖受容体へのGalNAcTの活性を測定した。その結果、ウシ乳腺組織では、糖受容体のモル数をそろえると、両受容体へのUDP-GalNAcから[3H]GalNAcの転移活性は同等であった。ウシ乳腺のGalNAcTは下垂体とは異なり、トリペプチド配列を認識しない別の酵素である可能性が考えられ、さらに酵素を精製して基質特異性を検討する必要がある。 興味深いことにウシとは異なり健常ヒトMFGM糖タンパク質糖鎖には、GalNAc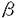 1→4GlcNAc構造は全く発現していなかった。ヒトの場合にも乳腺上皮細胞の変化と関係があるのではないかと考え、ヒト乳癌組織やヒト乳癌細胞(MRK-nu-1)の糖タンパク質をWFAを用いたレクチンブロットで解析した。その結果、これらの組織や細胞でWFAと結合する幾つかの糖タンパク質が検出された。また乳癌組織やMRK-nu-1細胞の糖タンパク質からヒドラジン分解で糖鎖を遊離させその構造を解析したところ、それぞれ全糖鎖の1.9%,4.4%がGalNAc 1→4GlcNAc構造は全く発現していなかった。ヒトの場合にも乳腺上皮細胞の変化と関係があるのではないかと考え、ヒト乳癌組織やヒト乳癌細胞(MRK-nu-1)の糖タンパク質をWFAを用いたレクチンブロットで解析した。その結果、これらの組織や細胞でWFAと結合する幾つかの糖タンパク質が検出された。また乳癌組織やMRK-nu-1細胞の糖タンパク質からヒドラジン分解で糖鎖を遊離させその構造を解析したところ、それぞれ全糖鎖の1.9%,4.4%がGalNAc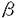 1→4GlcNAc構造をもつ複合型糖鎖であった。以上の結果から、ヒト乳腺組織の糖タンパク質では正常時にはGalNAc 1→4GlcNAc構造をもつ複合型糖鎖であった。以上の結果から、ヒト乳腺組織の糖タンパク質では正常時にはGalNAc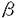 1→4GlcNAc構造をもつ糖鎖は発現していないかまたは極く少なく、細胞が癌化すると発現または増大してくるようになると考えられた。 1→4GlcNAc構造をもつ糖鎖は発現していないかまたは極く少なく、細胞が癌化すると発現または増大してくるようになると考えられた。 乳腺上皮細胞の機能分化や癌化の過程で見られる糖タンパク質糖鎖のN-アセチルガラクトサミニル化の機構を探るため、GalNAcT遺伝子のクローニングを試みた。ウシ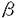 -1,4-ガラクトース転移酵素(GalT)とカタツムリで見い出された -1,4-ガラクトース転移酵素(GalT)とカタツムリで見い出された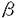 -1,4-N-アセチルグルコサミン転移酵素(GlcNAcT)は、共に複合型糖鎖側鎖のGlcNAc残基に -1,4-N-アセチルグルコサミン転移酵素(GlcNAcT)は、共に複合型糖鎖側鎖のGlcNAc残基に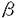 -1,4-結合でGalやGlcNAcを転移する。GalNAc -1,4-結合でGalやGlcNAcを転移する。GalNAc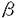 1→4GlcNAc構造を合成するGalNAcTも同じ基質に糖を転移するので、これら3つの糖転移酵素は基質と結合する相同性の高い領域をもつと考えられた。そこでGalTとGlcNAcTのアミノ酸配列で見られる相同性の高い領域を選び、これからプライマーを2種類作製し、ウシ乳腺mRNAから3’-RACE法で430bpのクローンを得た。このクローンはその推定されるアミノ酸配列でウシGalTと38%、遺伝子バンクに登録のあるヒトGalTに高い相同性をもつ遺伝子断片と77%のホモロージーが見いだされた。このクローンは何らかの糖転移酵素、あるいはそれに関連した分子をコードしている可能性が考えられた。 1→4GlcNAc構造を合成するGalNAcTも同じ基質に糖を転移するので、これら3つの糖転移酵素は基質と結合する相同性の高い領域をもつと考えられた。そこでGalTとGlcNAcTのアミノ酸配列で見られる相同性の高い領域を選び、これからプライマーを2種類作製し、ウシ乳腺mRNAから3’-RACE法で430bpのクローンを得た。このクローンはその推定されるアミノ酸配列でウシGalTと38%、遺伝子バンクに登録のあるヒトGalTに高い相同性をもつ遺伝子断片と77%のホモロージーが見いだされた。このクローンは何らかの糖転移酵素、あるいはそれに関連した分子をコードしている可能性が考えられた。 糖タンパク質のAsn型糖鎖に見い出されたGalNAc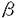 1→4GlcNAc構造の発現は、ウシ乳腺組織では細胞の機能分化と、一方ヒトでは乳腺上皮細胞の癌化と密接に相関していた。本研究で得られた結果は、糖鎖の発現調節機構の相異を制御する因子を調べる糸口となり、複合糖質糖鎖の生合成の調節機構や認識機構を解明する上で重要であると考えられる。 1→4GlcNAc構造の発現は、ウシ乳腺組織では細胞の機能分化と、一方ヒトでは乳腺上皮細胞の癌化と密接に相関していた。本研究で得られた結果は、糖鎖の発現調節機構の相異を制御する因子を調べる糸口となり、複合糖質糖鎖の生合成の調節機構や認識機構を解明する上で重要であると考えられる。 |