ムチンは、粘膜上皮により分泌される粘液の主成分であり、高分子量(20万以上)、高糖含量(分子量の50〜90%)で、主にコアペプチドのセリンまたはスレオニンに糖鎖が結合した糖タンパク質である。上皮細胞に発現されるものとしてはコアペプチドの違いによりMUC1〜MUC8がmRNAレベルで同定されている。もともと癌関連抗原として発見されたMUC1ムチンは、種々の腺癌で糖鎖修飾の変化や異所的発現がみられ、血清マーカーや免疫療法のターゲット分子として臨床応用されている。また乳癌のワクチン療法への応用も検討されている。私達は大腸癌では進行に伴いグリコシレーションの進んだMUC1ムチンの発現が上昇し、腎癌では悪性な癌ほどMUC1ムチンの発現量が高いことを明らかにしてきた。MUC1ムチンは上記のように腫瘍生物学において非常に注目されているため、生体内でいかなる発現制御をうけているかは興味深い研究課題である。MUC1ムチンの発現制御を研究するうえでin vitroでその発現を制御する系の確立が必要である。MUC1ムチンの発現をin vitroで変化させる因子の存在を調べた結果、正常大腸結合組織の培養上清(NCCM:normal colon conditioned medium)中に存在する液性因子が大腸癌細胞のMUC1ムチンの発現を誘導することを発見した。この発現誘導は転写レベルで制御されていることが示唆されている。私はこの液性因子によるMUC1ムチンの発現制御機構の解明を目的として実験を行なった。 1CATアッセイによる発現誘導を制御するDNA上流配列の同定 転写レベルの制御は、蛋白をコードする遺伝子のプロモーター領域へ転写因子が結合または遊離して行われていると考えられる。そこでMUC1遺伝子の上流配列の中でNCCMによる発現誘導をつかさどるシスエレメントの同定を試みた。MUC1遺伝子の上流配列約2.8kbをCAT(chloramphenicol acetyltransferase)遺伝子に接続したレポータープラスミドをもとに種々のデリーションプラスミドを作成した。これら種々のレポータープラスミピをヒト大腸癌細胞KM12Cにトランスフェクションし一過的に発現させ、NCCM存在下または非存在下で37℃2日培養後CAT活性を測定した。なおトランスフェクションの効率の違いによる実験誤差をなくすため、 ガラクトシダーゼ遺伝子の発現ベクターを同時にトランスフェクションして活性を測定した。上流配列を5’側から順次削除すると-531まではCAT活性の誘導に影響はないが、-520まで削除するとCAT活性の誘導はほとんどみられなくなった。このことから-531から-520の間にNCCM応答部があることが示唆された(1)。 ガラクトシダーゼ遺伝子の発現ベクターを同時にトランスフェクションして活性を測定した。上流配列を5’側から順次削除すると-531まではCAT活性の誘導に影響はないが、-520まで削除するとCAT活性の誘導はほとんどみられなくなった。このことから-531から-520の間にNCCM応答部があることが示唆された(1)。 次にFig.1Aの左のように3’側からデリーションし中間部分を欠損したレポータープラスミドを作成した。その結果-531から-488の44bpがNCCMによる発現誘導の最小単位であることが示唆された。 44bpのNCCM応答部が確かに発現誘導に必要であることを示すため、Fig.1Bの左に示すような2種類の変異を導入したレポータープラスミドを作成した。いずれの変異導入によっても発現誘導が起こらなくなった。このことから44bpのNCCM応答部の中で少なくとも-514から-512と-501から-499の2箇所は発現誘導に必須であることが示唆された。 2ゲルシフトアッセイによる結合蛋白の同定 -531から-488のNCCM応答部位に結合する因子が核抽出液中に存在するか調べる目的でゲルシフトアッセイを行なった。用いたDNAプローブは-531から-488の配列である。Fig.2に示すように移動度の遅れるバンドが複数存在したが、NCCM処理によってバンドの量や移動度の変化するものはみられなかった。このことよりNCCM処理によるMUC1の転写活性化は、DNAに結合していた因子が修飾を受けたためであることなどが考えられた。 さらに、Fig.1 Bに示した変異体をプローブとした時のゲルシフトアッセイのパターンを調べた(Fig.3)。-514から-512の変異体をプローブとした場合(probe B)のみ矢印で示す2本のバンドA、Bは消失した。このように-514から-512の配列を変異させると発現誘導も矢印の2本のバンドの結合も共に消失することから、この2本のバンドは発現誘導に関与していることが示唆された。一方、-501から-499の変異体をプローブとした場合(probe C )はこれらのバンドは検出されたので-501から-499の配列は発現誘導には必須であるがDNA結合因子によって直接認識される配列ではないことが示唆された。 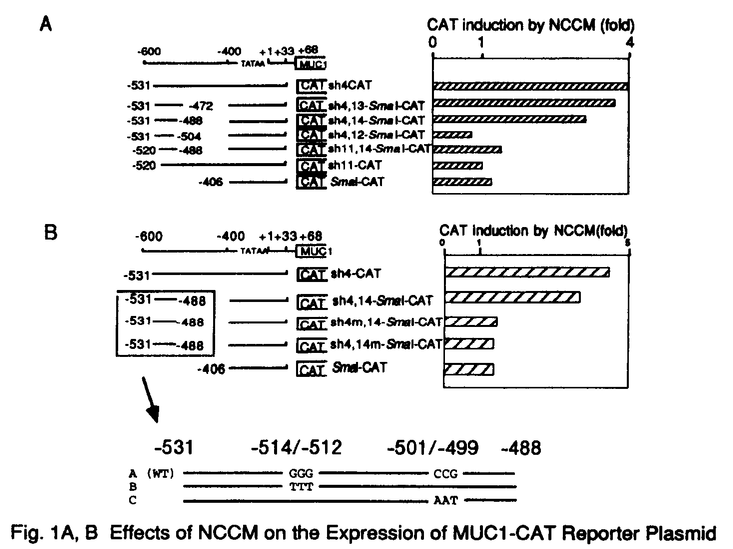 Fig.1A,B Effects of NCCM on the Expression of MUC1-CAT Reporter Plasmid Fig.1A,B Effects of NCCM on the Expression of MUC1-CAT Reporter Plasmid 以上のことより、Fig.3のバンドA、Bに含まれる因子の同定がNCCMによるMUC1ムチンの発現誘導のメカニズムを解明するうえで重要と考えられた。現在までに知られているDNA結合因子で-514から-512を含む配列を認識する因子をデータベースで検索した結果SP-1と癌転移抑制因子のNM23-H2が候補として挙げられた。これらの因子がバンドA、Bに含まれるかどうか抗体を用いて調べたがこれらの可能性は否定された。そこで新規のDNA結合因子がMUC1ムチンの発現を制御している可能性があり、精製を試みた。  図表Fig.2 Gelshift Assays with the Sequence between-531 and-488 as a Probe / Fig.3 Gelshift Assays with Mutated or Unmutated Probes3DNA結合因子の精製 図表Fig.2 Gelshift Assays with the Sequence between-531 and-488 as a Probe / Fig.3 Gelshift Assays with Mutated or Unmutated Probes3DNA結合因子の精製 精製の出発材料として乳癌細胞MRK-nu-1の核抽出液330mgを用い、S-Sepharose column→1 st DNA affinity column→2 nd DNA affinity column(carrier DNA 存在下)→Heparin-Sepharose column→Superose 6 gelfiltration columnによりゲルシフトアッセイにおける結合活性を指標に精製した。最後のSuperose 6 gelfiltrationcolumnによりバンドAの結合活性のピークはフラクション29に、バンドBの結合活性のピークはフラクション31に分画された。 Superose 6 gelfiltrationcolumnのフラクション27-32をSDS-PAGE後、銀染色しDNA結合活性と相関する蛋白の検出を行った。Fig.4のように、フラクション29に結合活性のピークが分画されたバンドAと相関している蛋白として分子量111、106、101、95k Dの4つが検出された。またフラクション31に結合活性のピークが分画されたバンドBと相関している蛋白として分子量66、64k Dが検出された。これらの蛋白がもしくは一部がDNA結合活性の本体である可能性がある。  Fig.4 Silver Staining of Fractions Separated by Superose 6 Gel Filtration Columnまとめ Fig.4 Silver Staining of Fractions Separated by Superose 6 Gel Filtration Columnまとめ 本研究により、私はNCCMによるMUC1ムチンの発現誘導に必要なシスエレメント(MUC1遺伝子の上流配列-531から-488)を決定した。-531から-488の配列に結合しかつNCCMによるMUC1ムチンの発現誘導に関与する因子をゲルシフトアッセイにおいて検出した(バンドA、B)。バンドA、BはNCCM処理により量や移動度の変化は見られなかったのでMUC1の転写活性化は、DNAに結合していた因子が修飾を受けたためであることなどが考えられた。バンドA、Bに含まれるDNA結合因子を精製したところ結合活性と相関している蛋白としてバンドAについては111、106、101、95 kDの4つの蛋白が、バンドBについては66、64 kDの2つの蛋白が精製された。それら精製された因子がDNA結合活性を有しているかを今後検討していく予定である。 今後の研究を通してMUC1ムチンの生理的病理的機能や分化に伴う発現制御機構などを明らかにしてゆきたいと考えている。 1) Shirotani et al.J.Biol.Chem.269 15030(1994) |