本研究は、ヒトのマクロファージに発現するガラクトース/N-アセチルガラクトサミン特異的C型レクチンのcDNAクローニングを行い、発現させたタンパク質が腫瘍関連抗原と見なされている糖鎖構造を認識することを明らかにして、このレクチンが腺癌細胞を認識する可能性を示したものである。さらに、このレクチンのゲノム遺伝子を得てその解析を行う一方、このレクチンによって認識される分子の分布を臨床病理学的に解析した。このようにユニークな広がりをもつ本研究は、基礎生物学と臨床医学の両面に大きく貢献するものである。 第一章は、ヒトマクロファージレクチンのcDNAクローニングに関する研究結果である。ヒト末梢血由来単球をIL-2存在下、一週間培養して誘導したマクロファージのmRNAから、ヒト肝レクチンのcDNA構造をもとに作製した合成オリゴヌクレオチドをプローブとしてプラークハイブレダイゼーション法によりスクリーニングを行い、3種類のcDNAクローンを得た。この成果は、新しいヒトの免疫細胞分化マーカーの発見と捉えることができる。 第二章では、リコンビナント型のヒトマクロファージレクチンの糖結合特異性を解析した結果が述べられている。単糖、オリゴ糖、及び糖ペプチドの結合特異性が解析された。その結果、セリン/スレオニン結合型糖鎖を持つヒトグリコホリンA由来の糖ペプチドおよびその糖鎖末端のシアル酸を除去して末端をガラクトースにしたもの(T抗原)では親和性が見られなかった。ところがさらにガラクトース残基を除去して末端をN-アセチルガラクトサミンにしたもの(Tn抗原)では親和性は著しく上昇した。また、NeuAc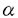 2-6GalNAcを糖鎖として持つ糖ペプチド(シアリルTn抗原:ここでは合成品を用いた)においても強い親和性が見られた。したがってヒトのマクロファージレクチンは、腺癌の腫瘍関連抗原として知られているこれらのムチン糖鎖に強く結合することが示された。 2-6GalNAcを糖鎖として持つ糖ペプチド(シアリルTn抗原:ここでは合成品を用いた)においても強い親和性が見られた。したがってヒトのマクロファージレクチンは、腺癌の腫瘍関連抗原として知られているこれらのムチン糖鎖に強く結合することが示された。 第三章では、ヒトマクロファージレクチンのゲノム遺伝子の構造解析を行った結果が述べられている。ヒトマクロファージレクチンcDNAをプローブとし、コスミドベクターに挿入されたヒトゲノムのライブラリーからヒトマクロファージレクチン遺伝子を含むクローンを単離し、塩基配列およびエクソン-イントロンの境界線を決定した。その結果、ヒトマクロファージレクチンの3種類のcDNAは、単一の遺伝子からGT-AGルールに従い選択的スプライシングによって生じたものであることが明らかとなった。 第四章では、リコンビナント型のヒトマクロファージレクチンのヒト大腸癌細胞への結合性が査定された。結合性は、Tn抗原の発現量と相関していた。Tn抗原およびシアリルTn抗原を多く発現しているヒト大腸癌細胞にあらかじめ組換体ヒトマクロファージレクチンを結合させておくと抗Tn抗体、抗シアリルTn抗体の細胞への結合は阻害された。また、逆にヒトマクロファージレクチンの結合はこれらの抗体の共存下で阻害された。したがってヒトマクロファージレクチンは、ヒト大腸癌細胞株に対してTn抗原とシアリルTn抗原を介して結合することが示唆された。ヒトマクロファージレクチンはヒト大腸癌細胞のTn、シアリルTn抗原を含むムチン糖タンパク質を認識することが示された。 第五章では、 ヒトマクロファージレクチンのヒト胃癌組織に対する結合性を、組織化学的に検出するという新しい方法に基づく実験の結果が示されている。ヒトマクロファージレクチンの結合は非癌部腺窩細胞、胃底腺細胞と胃癌細胞に認められた。結合は57%の症例で認められたが、癌細胞への結合はこの症例中の60%であった。癌細胞へ結合した症例の組織型に特徴は認められなかったが、印環細胞癌の場合は細胞質に、腺管形成性の場合は細胞質よりも分泌物や腺腔内側部に強く結合する傾向が見られた。ヒトマクロファージレクチンの結合部分は、Tn抗原を認識するモノクローナル抗体およびレクチンの組織染色陽性部と大部分一致していた。これらの結果は、ヒトマクロファージレクチンが特定の糖鎖抗原を発現した胃癌細胞を認識して結合することを明白に示していた。 従来のモノクローナル抗体や植物レクチンを用いた研究からTn抗原、シアリルTn抗原は、ヒトの腺癌細胞にしばしば発現する腫瘍関連抗原であることが知られていたが、学位申請者鈴木詔子による本研究の結果、ヒトマクロファージの細胞表面分子と考えられる内在性のレクチンによってこれらの腫瘍関連抗原が認識されることが明らかとなった。マクロファージはエフェクター細胞としてだけでなく、抗原提示細胞として、またサイトカインの産生を通して癌に対する免疫学的な防御機構の重要な役割を担っていると考えられており、その表面分子であるレクチンによって腫瘍関連抗原が認識されることが示された意義は大きい。癌は形質を異にする不均一な癌細胞集団から成ることが知られているが、この不均一性はしばしば癌の進行に伴う様々な形質変化によって生じ、浸潤性や転移性に強い影響を与える。癌細胞集団において不均一な分布を示すTn抗原、シアリルTn抗原の様な糖鎖構造も多くの臨床例から癌の進行に伴う形質変化のマーカーであると見なされている。本研究の成果は、ヒトの癌細胞が内在性のエフェクター細胞によって認識されて排除される場合と、この認識から逃れて播種と転移を引き起こす場合とで、何が異なるかを知る上で重要な知見を与えると考えられる。これらの研究成果は腫瘍学及び免疫学に資するところが大であり、学位申請者は博士(薬学)の学位を受けるに十分であると判断した。 |