RNA酵素の発見以来、自己切断、リン酸化、低分子化合物認識など様々な機能を持つRNAが天然より発見され、または試験管内進化により人工的に得られてきている。このようにRNAは様々な機能を持つにもかかわらず、その機能を実現する高次構造は数例のtRNAの結晶構造がえられているだけでよくわかっていない。本研究ではNMRによるRNAの高次構造の解析法の開発を行った。理由としては、近年飛躍的に進歩したNMRによる蛋白質の構造解析の手法をRNAに応用できれば同様の飛躍が期待されること、RNA酵素の活性に重要な水溶液中での動的な構造とNMRとの相性がいいことなどである。 NMRによるRNAの高次構造解析はタンパク質のそれに比べ著しく立ち後れている。蛋白質に比べシグナルの重なりが著しいことが主な理由である。蛋白質では安定同位体標識法と多次元多重共鳴NMR法によりシグナルの分離に成功した。したがって、RNAの構造解析も安定同位体標識技術の導入により飛躍的な進歩が期待される。この考えは世界の研究者に共通していて、生体高分子の中で触媒活性を持つRNAは、蛋白質の次の構造解析の標的として、注目を浴びている。 本研究では、13Cと15Nを含む培地で酵母または大腸菌を培養し、多段階のプロセスを経てヌクレオシド5’トリリン酸を調製し、in vitro転写反応により、ほぼ任意の配列の13Cおよび15N標識RNAを調製する一般的方法を確立した。標識RNAの調製法は現在、世界中で開発中であるが、本研究で開発された方法は、安価な13C源と高い転写効率により低コストである点、有機合成などの特殊な技術を必要としない点で秀でている。また15N単独標識も可能で、実際にわれわれのグループでtRNAの研究に応用されている。 調製されたヌクレオチドとモデルRNA(後述)を用い、多次元NMR法について検討した。13C-1H HMQCスペクトルでは、リボースC1’からC5’まで化学結合の違う炭素のシグナルはよく分離される。しかし、同じ位置の炭素(例えばリボースC1’の領域)のなかではシグナルが重なりあうことが指摘されていた。この点、塩基タイプ選択的標識を行うと、25残基(分子量8千)のRNAでも効果的にシグナルが分離され、リボースC1’では個々のピークがはっきりと分離されることが示された(図1)。また、この塩基タイプ選択的標識法と13C half-filter NOESYを組み合わせると、込み合ったNOEピークが簡略化され、残基内と残基間のクロスピークが区別することができた。これまで塩基タイプ選択的標識は2例報告されているが、13C half-filter NOESYと組み合わせた例は初めてである。また、この大きさのRNAではっきり分離したシグナルが得られたことは、より大きな系でのRNAの構造解析に希望をあたえた。 RNAでは、リボース1’カーボン、プロトンのケミカルシフトがもっとも分離している。したがって、シグナルの込み合う近接する原子からリボース1’プロトンに効率よく磁化をつたえることは帰属を行う上で重要である。本研究により初めてRNAに適用された異核交差緩和を利用したHEHOHEHAHAスペクトルでは、従来のHCCH-TOCSYよりも効率よくリボースプロトンの磁化が伝わることが示された。このパルス列を他の複雑なパルス列に組み込むことで分離したリボース1’カーボン、プロトンのケミカルシフトを利用した帰属が可能になると考えられる。 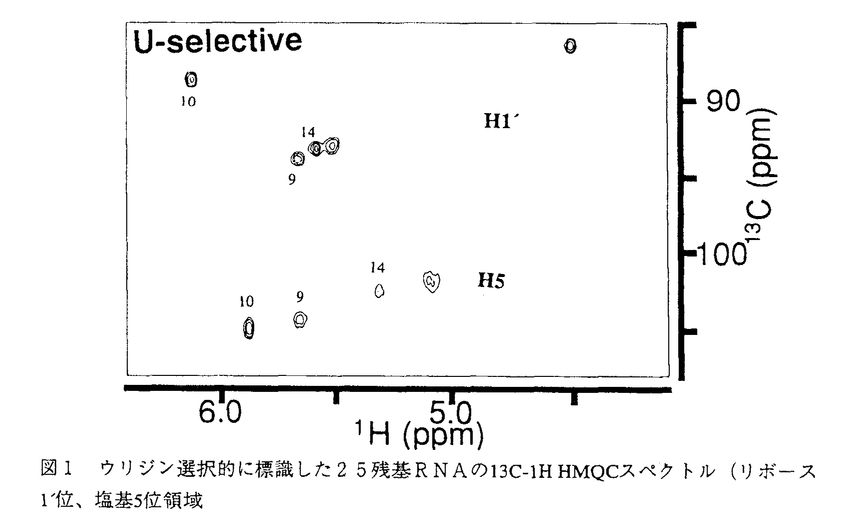 図1 ウリジン選択的に標識した25残基RNAの13C-lH HMQCスペクトル(リボース1’位、塩基5位領域 図1 ウリジン選択的に標識した25残基RNAの13C-lH HMQCスペクトル(リボース1’位、塩基5位領域 現在、RNAの多重共鳴実験は、12残基(自己相補的)から30残基のRNAに適用された例が報告されていて、構造解析に適した大きさは30残基(分子量1万)程度までと考えられている。しかし、触媒活性を持つRNAはほとんど巨大分子であり、解析に適した低分子量のものは極めて少ない。したがって、解析可能な低分子量のモデルRNAでも巨大分子の機能を持ちえることを示すことは、RNAの機能と構造の相関を調べる上で重要である。本研究では、巨大分子テトラヒメナrRNA前駆体のグループIイントロンによるグアノシン残基の認識に着目した。31残基モデルRNA(図2)はP7およびP9.0ステムとイントロンの3’末端のグアノシン残基(以後3’-Gと呼ぶ)を人工的につないだ低分子RNAである。 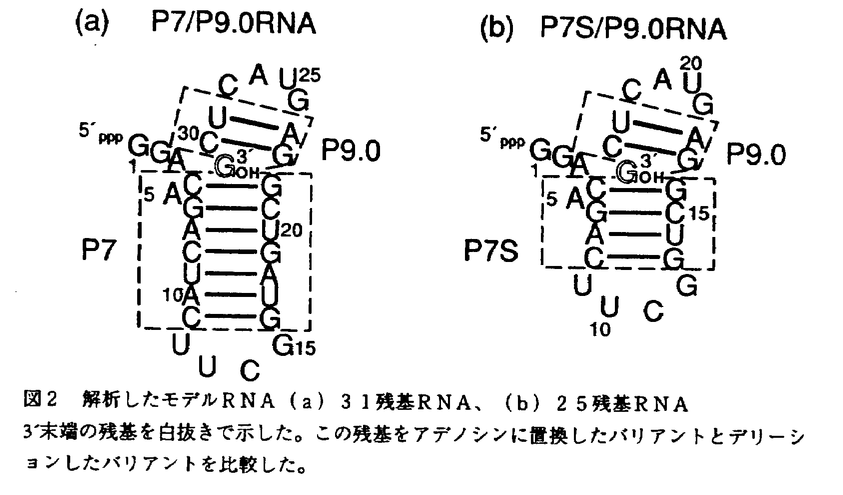 図2 解析したモデルRNA(a)31残基RNA、(b)25残基RNA3’末端の残基を白抜きで示した。この残基をアデノシンに置換したバリアントとデリーションしたバリアントを比較した。 図2 解析したモデルRNA(a)31残基RNA、(b)25残基RNA3’末端の残基を白抜きで示した。この残基をアデノシンに置換したバリアントとデリーションしたバリアントを比較した。 グループIイントロンは最も解析の進んだRNA酵素で、スプライシング反応の一段階目では遊離のグアノシンが、2段階目では3’-Gが基質として認識される。遊離のグアノシンの認識機構は調べられているが、3’-Gの認識機構は、いままでほとんど解析がされていなかった。そこで、認識されると期待される3’-Gに依存したモデルRNAの構造変化をヌクレアーゼ感受性実験とUV融解曲線の解析により調べた。31残基モデルRNAは2段階のUV融解曲線を示した。高い方の融解温度は共通であるのに対し、低い方の融解温度はRNAの3’末端の残基への依存性がみられた。3’末端がグアノシンの時にはアデノシンに比べて+5℃シフトしたことより3’-Gの認識能があることが示された。3’-Gのの認識に伴い局所的なコンホメーション変化が予想されるグアノシン結合部位(P7-2)に近接した残基およびP9.0をつなぐループ部分で起こることがヌクレアーゼ感受性実験より示された(図3)。イミノプロトンの解析から、このRNAは構造的に(P7-2)を境に2つのサブドメイン構造をとり、3’末端がコグネイトなグアノシンのときには3’末端を固定して、P9.0を含むサブドメインの安定化に寄与することがわかった。さらに切り詰めた25残基RNA(図2)で同様の解析を行ったところ、グアノシン認識能は25残基RNAでも保たれていることが確かめられた。全長のグループIイントロンでは、3’スプライスサイトはイントロン内部のガイド配列(IGS)と3’エキソンが相補的な塩基対をつくることで認識されるが、IGSの非存在下でも(P7-2)にあるグアノシン結合サイトにより3’-Gが認識されることが示唆されていた。本研究に用いたモデルRNAはIGSを含まないため、この全長の系の3’-Gの認識を強く示唆する。 全長のグループIイントロンではグアノシン結合サイトにグアノシンとL-アルギニンが競争的にが結合し、スプライシングの活性を阻害することが知られている。この阻害はL-アルギニンに特異的に起こり、他のアミノ酸での阻害はずっと小さいことが知られている。もしこのモデルRNAで全長のRNAの3’-Gの認識を再現しているとすると、L-アルギニン特異的な相互作用がみられると期待された。100m ML-アルギニン存在下では25残基モデルRNAの融解温度のシフトがみられた。このシフトは同じ塩基性のアミノ酸であるL-リジン存在下ではみられなかったことから、このRNAはL-アルギニンの認識能も持つことがわかった。さらに3’-Gをアデノシンに置換したRNAでは、L-アルギニン、L-リジンともに融解温度のシフトは見られなかったことから、アルギニン結合サイトは3’-Gにより誘導されることが示唆された。3’-Gとアルギニン結合サイトの関係は全長のグループIイントロンでは解析された例はなく、本研究の結果は全長の系に問題を提起した。 低分子量のモデル系を構築したため、有機合成的手法により特定の残基(P7-2)、(P7-1’)および3’末端にイノシンを導入し解析を行った(図3)。3’-Gの認識には3’-G、(P7-1’)、(P7-2)にあるグアノシン残基の2位のアミノ基はそれぞれ重要であるがその影響は異なっていた。UV融解温度を指標として3’末端の残基の結合の安定性をみつもると、3’末端がグアノシン、イノシン、アデノシンの順に安定であった。P9.0ステムのイミノプロトン強度も同じ傾向を示した。これは全長の系の遊離のプリンヌクレオチドのKmまたはKiの順に対応する。グアノシン(P7-1’)をイノシンに置換すると3’末端の残基がグアノシンとアデノシンとで融解温度に差がみられなかった。既存のモデルではグアノシン結合サイトはmajor grooveに位置されており、minor grooveにある2位のアミノ基の影響が3’-Gの認識に大きな影響を持つことが示されたのは驚くべき結果である。グアノシン(P7-2)をイノシンに置換すると、高い方の融解温度が10℃以上低くなり、イミノプロトンシグナルが全く異なったパターンを示した。この(P7-2)はグアノシン結合サイトと考えられ、全長の系ではこの塩基対を他の塩基に置換するとスプライシング活性は著しく低下することが知られている。この塩基対は通常の塩基対よりもストレスがかかっていて、3本の水素結合のGC塩基対によってしっかりと固定される必要があると考えられる。 本研究では、巨大RNAから3’-Gの認識に必要な要素を切り出して低分子モデルRNAをデザインした。実際に3’-Gを特異的な相互作用が取り出せたことを確認し、L-アルギニンの認識能もあることを明らかにした。有機合成的にイノシンを導入することで巨大RNAでは困難であった3’-G認識に必要な要素の一部を官能基レベルで同定した。モデルRNAの解析結果は全長の系の解析結果と合うだけでなく、全長の系に対し問題を提起した。本研究で提案された「巨大RNAからの活性のある小分子の切り出す」考え方は、まだRNAの解析方法として確立した方法ではない。しかし、巨大RNAの機能を議論する潜在的な戦略となる方法であり、今後、安定同位体標識NMR法の発展と伴い、一般的になっていくと信じている。 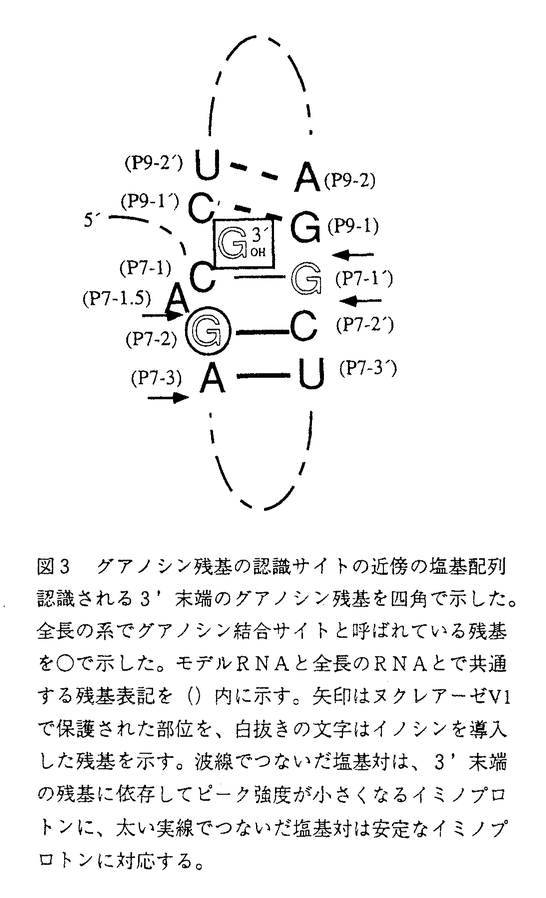 図3 グアノシン残基の認識サイトの近傍の塩基配列認識される3’末端のグアノシン残基を四角で示した。全長の系でグアノシン結合サイトと呼ばれている残基を○で示した。モデルRNAと全長のRNAとで共通する残基表記を()内に示す。矢印はヌクレアーゼV1で保護された部位を、白抜きの文字はイノシンを導入した残基を示す。波線でつないだ塩基対は、3’末端の残基に依存してピーク強度が小さくなるイミノプロトンに、太い実線でつないだ塩基対は安定なイミノプロトンに対応する。 図3 グアノシン残基の認識サイトの近傍の塩基配列認識される3’末端のグアノシン残基を四角で示した。全長の系でグアノシン結合サイトと呼ばれている残基を○で示した。モデルRNAと全長のRNAとで共通する残基表記を()内に示す。矢印はヌクレアーゼV1で保護された部位を、白抜きの文字はイノシンを導入した残基を示す。波線でつないだ塩基対は、3’末端の残基に依存してピーク強度が小さくなるイミノプロトンに、太い実線でつないだ塩基対は安定なイミノプロトンに対応する。 |