翻訳終結過程はmRNAから蛋白質への一連の翻訳過程の中で最も未解明な分野である。その要因として、関与する因子の解析の困難さや伸長反応の延長として誤解されてきたことが挙げられる。しかし、近年、特定の終止コドンUGAのセレノシステインへの翻訳やRF2遺伝子の自己発現制御がコドンのフレームシフトを利用し翻訳終結過程で行なわれることなど、翻訳終結は遺伝子発現制御にも独自の機構をもって関与することが分かってきた。また、コドン認識をtRNAで行う伸長反応に対して、タンパク質性の因子が終止コドンを認識する終結反応は、タンパク質によるRNA認識という新たな問題を提起すると共に単なる伸長反応の延長ではなく、独自の機構を持つことを想定させる。したがって、翻訳終結機構の解明は翻訳過程の統一的な理解のために必須な課題である。 一般に翻訳終結は、蛋白質性の因子として、直接終止コドンを認識しペプチド鎖のリボソームからの解離反応を触媒する因子とその因子の活性を促進させる因子の2種類の因子が関与し、これらの因子が生物種に関わらず保存されていることが明らかになってきた。このため、翻訳終結は生物界全体で共通の機構を持つと考えられる。我々は解析の容易な形として大腸菌に注目した。 大腸菌の翻訳終結反応には、直接にペプチド鎖解離反応を触媒しこドン特異性を持った二つの因子RF1,RF2と、コドン非特異的でRF1,RF2の活性を促進させる因子RF3が関与している。このうち、RF3はGTP結合活性を持ち翻訳終結過程の重要なスイッチ分子であると考えられるので、その機能の解析は翻訳終結機構の解明のために不可欠である。このRF3因子について、RF1,RF2との相互作用の有無の検証、及び機能ドメインの解析を目的として以下の研究を行った。 (1)RF3が大腸菌の成長に必須な因子であるかいなかを検証するため、RF3のORF内部の約400bpの塩基配列をカナマイシン耐性遺伝子と入れ換えてRF3完全破壊変異を作製した。RF3欠損変異は全ての終止コドンの誤読を誘発するが、大腸菌の成長を必ずしも阻害しなかった。ただし、特定の遺伝的背景及び環境要因下(具体的にはMC4100またはDEVシリーズの背景で、低塩濃度の場合)では、高温致死性を誘因することが分かった。 (2)RF2の高温致死変異を自発的に抑圧する大腸菌株を分離しその変異部位を解析したところ、RF3の存在する99minの位置に変異部位が存在することが分かった。このため、この変異大腸菌株からRF3遺伝子をクローニングし塩基配列を決定したところ、RF3のプロモーター領域と思われる部分にCの1塩基挿入変異が存在していた。そこで、この変異によってRF3の発現量に変化を生じRF2変異が抑圧されていると予想し、northem blot hybridizationでRF3の転写量を測定したところ、確かに変異大腸菌ではRF3の転写量が数倍に増大していた。さらに、RF3-LacZ融合遺伝子を作製し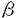 -ガラクトシダーゼの活性を指標にRF3の発現量を測定したところ、5倍に増大していることが分かった。このことからRF3の発現量の増大でRF2の高温致死変異が抑圧されると推定した。 -ガラクトシダーゼの活性を指標にRF3の発現量を測定したところ、5倍に増大していることが分かった。このことからRF3の発現量の増大でRF2の高温致死変異が抑圧されると推定した。 (3)RF3とRF1,RF2の相互作用の有無を検証するため、プラスミドを用いて多コピーのRF3遺伝子をRF1,RF2の変異を持つ大腸菌に形質導入した。その結果、多コピーのRF3は全ての終止コドンのアミノ酸への誤読(readthrough)を抑制した。また大量のRF3の存在がRF2の高温致死変異を抑圧することも明らかにした。RF1の高温致死変異についても弱くはあったが抑圧することができた。このことはRF3がRF1,RF2と機能的に相互作用することを示している。さらに、RF3遺伝子をlac promoterの下流につないでIPTG濃度に応じてRF3の発現量を制御することが可能なプラスミドを作製し、RF1,RF2の高温致死変異の抑圧に必要なRF3量を測定した(図1)。この結果、RF2の変異を抑圧するには通常の約3倍のRF3の発現量を必要とし、RF1の変異を抑圧するには15倍の発現量でも変異抑圧は不可能であることが分かっな。このことはRF3がRF1よりもRF2に対して高い親和性を持つことを示唆しているが、RF1,RF2の変異の強度の問題もあり確定的ではない。 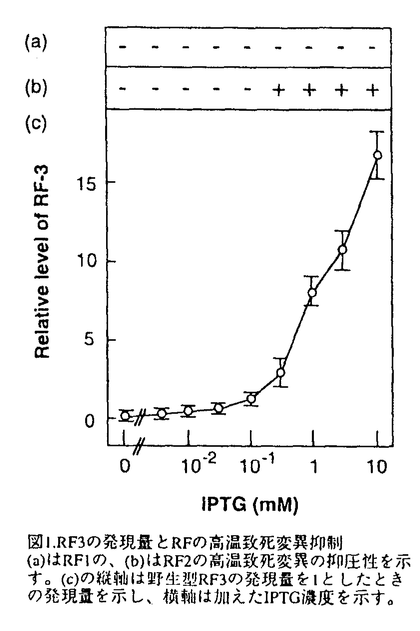 図1.RF3の発現量とRFの高温致死変異抑制(a)はRF1の、(b)はRF2の高温致死変異の抑圧性を示す。(c)の縦軸は野生型RF3の発現量を1としたときの発現量を示し、横軸は加えたIPTG濃度を示す。 図1.RF3の発現量とRFの高温致死変異抑制(a)はRF1の、(b)はRF2の高温致死変異の抑圧性を示す。(c)の縦軸は野生型RF3の発現量を1としたときの発現量を示し、横軸は加えたIPTG濃度を示す。 (4)RF1の高温致死変異を抑圧するためには、RF2の変異を抑圧するよりはるかに高コピー数のRF3が必要であった。そこで低コピー数でも変異抑圧を達成することのできるRF3側の変異(Suppressor of prfAl-sra変異)を分離し、RF1,RF2の翻訳終結活性に影響を与えるRF3の機能部位を同定しようと試みた。複数の変異RF3を分離しその変異部位を解析したところ、その変異部位はN末端側の2箇所(sra1,sra2)、C末端側の2箇所(sra3,sra4)に局在することが分かった。これらの変異RF3の翻訳終結促進活性を検証するために変異RF3を持つプラスミド存在下でORF内に終止コドンを持つlacZ遺伝子の発現量を比較した(図2)。その結果、変異RF3は、RF1の関与するUAG,UAAのみならず、RF2の関与するUGAに対する翻訳終結促進活性も強化されていた("SuperRF3")。また、N末端とC末端の変異を組み合わせて二重の変異体を作製したところ、翻訳終結促進活性はさらに強化された。このことからN末端領域の変異とC末端領域の変異は互いに独立した経路でRF3の活性に影響を与えていることが明らかになった。さらに、sra変異部位のRF3の活性に対する影響を確認するために、sra変異部位に別のアミノ酸を導入し、その変異RF3の活性を解析した。この解析から、sra2,sra4の変異部位に特定のアミノ酸変異を導入することで、RF3の機能が低下することが示された。このことから、これらの変異部位のアミノ酸は、RF3がその生理活性を発現していくうえで重要な役割を担っていると考えられる。 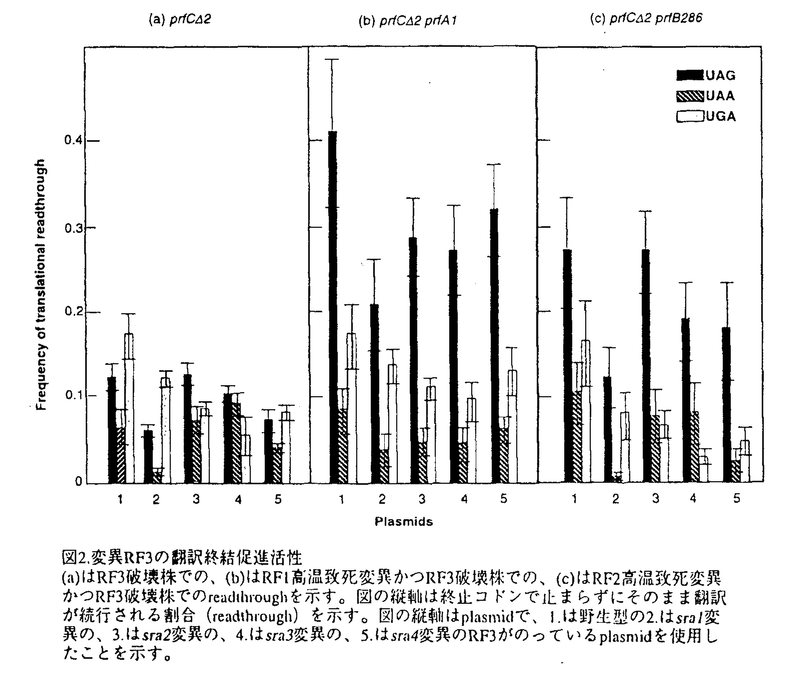 図2.変異RF3の翻訳終結促進活性(a)はRF3破壊株での、(b)はRF1高温致死変異かつRF3破壊株での、(c)はRF2高温致死変異かつRF3破壊株でのreadthroughを示す。図の縦軸は終止コドンで止まらずにそのまま翻訳が続行される割合(readthrough)を示す。図の縦軸はplasmidで、1.は野生型の2.はsral変異の、3.はsra2変異の、4.はsra3変異の、5.はsra4変異のRF3がのっているplasmidを使用したことを示す。 図2.変異RF3の翻訳終結促進活性(a)はRF3破壊株での、(b)はRF1高温致死変異かつRF3破壊株での、(c)はRF2高温致死変異かつRF3破壊株でのreadthroughを示す。図の縦軸は終止コドンで止まらずにそのまま翻訳が続行される割合(readthrough)を示す。図の縦軸はplasmidで、1.は野生型の2.はsral変異の、3.はsra2変異の、4.はsra3変異の、5.はsra4変異のRF3がのっているplasmidを使用したことを示す。 これまで遅々として研究が進まなかったは翻訳の終結過程であるが、近年、多くの生物種で翻訳終結に関わる因子のクローニングが行なわれ、一連の因子がホモログとしてまとめられてきた。さらに翻訳終結に直接関わるRF1の立体構造予測から、その三次元的構造がtRNAと類似していること、真核生物のeRF-3がEF-1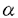 と相同性を持つことが明らかになり、タンパク質性の因子が関与する翻訳終結反応も、翻訳伸長反応と似た機構を持つことが予想されるようになってきた。大腸菌のRF3はEF-Gと相同性を持ち、真核生物のものとは異なった機構をもって翻訳終結反応を促進していると考えられるが、翻訳伸長過程との類似性と行った観点で見るとその機能解析は真核生物のeRF-3と同様に重要であろう。上記の研究の結果、解離因子間の機能的な相互作用が確認され、RF3が翻訳終結反応の一過程に関与することが確認された。また、新たに分離されたRF3の機能強化変異の解析を進めることで、RF3の機能構造の解明に重要な知見を加えることができた。これらの変異のさらなる解析により、より詳細なRF3の機能解析が可能になり、翻訳終結の分子機構が明らかになるものと考える。 と相同性を持つことが明らかになり、タンパク質性の因子が関与する翻訳終結反応も、翻訳伸長反応と似た機構を持つことが予想されるようになってきた。大腸菌のRF3はEF-Gと相同性を持ち、真核生物のものとは異なった機構をもって翻訳終結反応を促進していると考えられるが、翻訳伸長過程との類似性と行った観点で見るとその機能解析は真核生物のeRF-3と同様に重要であろう。上記の研究の結果、解離因子間の機能的な相互作用が確認され、RF3が翻訳終結反応の一過程に関与することが確認された。また、新たに分離されたRF3の機能強化変異の解析を進めることで、RF3の機能構造の解明に重要な知見を加えることができた。これらの変異のさらなる解析により、より詳細なRF3の機能解析が可能になり、翻訳終結の分子機構が明らかになるものと考える。 |