| 内容要旨 | | 序論 固形癌の薬剤抵抗性は,癌化学療法の治療成績を著しく低下させる要因となっている。これには,固形癌特有の耐性メカニズムの関与が考えられているが,その実体についてはほとんど明らかになっていない。固形癌では血管形成が異常なために,癌細胞は低酸素状態・栄養飢餓状態などの特殊な環境ストレスにさらされている。こうしたストレスに対する細胞応答としてグルコース調節ストレス応答がある。当研究室ではこれまでに,ストレス応答したヒト癌細胞が種々の抗癌剤に耐性を示すことを見い出し,このストレス応答が固形癌の耐性因子である可能性を示してきた。ストレス応答した癌細胞は,種々の抗癌剤のなかでもDNA topoisomeraseII(topoII)阻害剤のVP-16,Adriamycinに対して強い耐性を示すが,この耐性機序として標的分子であるtopoII の発現が著しく低下することが明らかになっている。しかしながら,どのようなメカニズムでtopoII の発現が著しく低下することが明らかになっている。しかしながら,どのようなメカニズムでtopoII の発現が低下するかについては明らかにされていない。本研究で私は,ストレスによって細胞周期の進行が抑制されG1 arrestが起こることに着目し,topoII の発現が低下するかについては明らかにされていない。本研究で私は,ストレスによって細胞周期の進行が抑制されG1 arrestが起こることに着目し,topoII の発現低下とG1 arrestとの関係,さらにはtopoII の発現低下とG1 arrestとの関係,さらにはtopoII の発現低下のメカニズムについて解析し,以下の成果を得た。本研究は,ストレスによる耐性の誘導機序を理解する手掛かりになるものと考えられる。 の発現低下のメカニズムについて解析し,以下の成果を得た。本研究は,ストレスによる耐性の誘導機序を理解する手掛かりになるものと考えられる。 1.ストレスによるtopoII の発現低下とG1 arrest の発現低下とG1 arrest グルコース調節ストレス応答は,カルシウムイオノフォアA23187や糖鎖合成を阻害するglucosamine,2-deoxyglucoseなどの処理よってin vitroの培養系で容易に誘導できる。このストレス応答した細胞では,GRPと呼ばれる一群のストレスタンパク質の発現が誘導される。実際,ヒト大腸癌HT-29細胞を1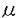 MのA23187で24時間処理すると,GRP78の発現量が3〜4倍程度増大した。このストレス応答したHT-29細胞では,topoII MのA23187で24時間処理すると,GRP78の発現量が3〜4倍程度増大した。このストレス応答したHT-29細胞では,topoII の発現量が著しく低下することがウェスタンブロッティング法によって確認された。FACS解析の結果,A23187処理によってG1期の細胞の割合が未処理の細胞に比べ増大し,ストレス応答したHT-29細胞でG1 arrestが起こることが示された。 の発現量が著しく低下することがウェスタンブロッティング法によって確認された。FACS解析の結果,A23187処理によってG1期の細胞の割合が未処理の細胞に比べ増大し,ストレス応答したHT-29細胞でG1 arrestが起こることが示された。 エルトリエーターを用い対数増殖しているHT-29細胞をG1,S,G2/M期に分画したところ,topoII の発現は各細胞周期でほとんど変動しないことが明らかになった。すなわち,対数増殖している細胞のG1期には,topoII の発現は各細胞周期でほとんど変動しないことが明らかになった。すなわち,対数増殖している細胞のG1期には,topoII の発現低下は起こらないことがわかった。 の発現低下は起こらないことがわかった。 2.M期進行阻害剤によるtopoII 発現低下の抑制 発現低下の抑制 ストレスによるtopoII の発現低下が,細胞周期上の特異的な時期に起こるかどうかを検討するため,M期の進行を阻害するnocodazoleを用い検討した。nocodazole 40ng/mlとA23187 1 の発現低下が,細胞周期上の特異的な時期に起こるかどうかを検討するため,M期の進行を阻害するnocodazoleを用い検討した。nocodazole 40ng/mlとA23187 1 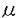 Mとを同時に処理すると,A23187によるG1期の細胞の蓄積は見られず,M期に細胞が蓄積することがわかった。A23187によるGRP78の発現誘導はnocodazoleの同時処理によって阻害されなかったことから,ストレス応答自体はnocodazole存在下においても起こることが確認された。このストレス応答したM期の細胞を用い,topoII Mとを同時に処理すると,A23187によるG1期の細胞の蓄積は見られず,M期に細胞が蓄積することがわかった。A23187によるGRP78の発現誘導はnocodazoleの同時処理によって阻害されなかったことから,ストレス応答自体はnocodazole存在下においても起こることが確認された。このストレス応答したM期の細胞を用い,topoII の発現量を調べたところ,ストレス応答していないコントロールのM期の細胞と比べ全く差がないことが明らかになった。こうしたM期停止によるtopoII の発現量を調べたところ,ストレス応答していないコントロールのM期の細胞と比べ全く差がないことが明らかになった。こうしたM期停止によるtopoII 発現低下の抑制は,他のM期進行阻害剤であるcolcemid,vincristineを用いても同様に観察された。 発現低下の抑制は,他のM期進行阻害剤であるcolcemid,vincristineを用いても同様に観察された。 3.ストレスによるtopoII の発現低下はG1期に起こる の発現低下はG1期に起こる 上記のように,ストレス応答した細胞においても,細胞周期がM期に停止するとtopoII の発現低下が起こらないことが明らかになった。そこで,nocodazoleを用い,M期同調培養系を構築した。HT-29細胞を1 の発現低下が起こらないことが明らかになった。そこで,nocodazoleを用い,M期同調培養系を構築した。HT-29細胞を1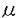 MのA23187存在下あるいは非存在下にて,nocodazole 40ng/mlで10時間処理した後,round-upしたM期の細胞をmitotic shake-off法によって回収した。このnocodazoleからのrelease後,1 MのA23187存在下あるいは非存在下にて,nocodazole 40ng/mlで10時間処理した後,round-upしたM期の細胞をmitotic shake-off法によって回収した。このnocodazoleからのrelease後,1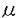 MのA23187存在下あるいは非存在下で培養を続けた。A23187未処理のcontrol細胞では,mitotic shake-off後,培養時間依存的にG1期の細胞の割合が増加し,6時間後にピークに達した。9時間後にはS期の細胞の割合がピークとなり,M期からS期の間での同調が確認された。一方,A23187処理によりストレス応答した細胞では,M期からG1期への進行はcontrol細胞とほぼ同様の経時変化で起こるが,G1期からS期への進行は抑制されG1 arrestが確認された。 MのA23187存在下あるいは非存在下で培養を続けた。A23187未処理のcontrol細胞では,mitotic shake-off後,培養時間依存的にG1期の細胞の割合が増加し,6時間後にピークに達した。9時間後にはS期の細胞の割合がピークとなり,M期からS期の間での同調が確認された。一方,A23187処理によりストレス応答した細胞では,M期からG1期への進行はcontrol細胞とほぼ同様の経時変化で起こるが,G1期からS期への進行は抑制されG1 arrestが確認された。 このM期同調培養系を用い,topoII の発現量の変化を調べた。control細胞では,M期からS期にかけてtopoII の発現量の変化を調べた。control細胞では,M期からS期にかけてtopoII の発現量は一定であった。これは,エルトリエーターの実験結果と良く一致している。一方,A23187処理によってストレス応答した細胞では,M期からrelease後6時間はtopoII の発現量は一定であった。これは,エルトリエーターの実験結果と良く一致している。一方,A23187処理によってストレス応答した細胞では,M期からrelease後6時間はtopoII の発現量に変化は見られなかったが,9時間以降に急激に低下することが明らかになった。M期から6時間後には,細胞周期は既にG1期に進行していることから,ストレスによるtopoII の発現量に変化は見られなかったが,9時間以降に急激に低下することが明らかになった。M期から6時間後には,細胞周期は既にG1期に進行していることから,ストレスによるtopoII の発現低下はG1期で起こることが明らかになった。 の発現低下はG1期で起こることが明らかになった。 4.ストレスによるtopoII の発現低下とproteolysis の発現低下とproteolysis ストレス応答した細胞においてG1期に起こるtopoII の発現低下の機序について,先のM期同調培養系を用いて検討した。まず,タンパク質合成阻害剤cycloheximide(CHX)とA23187とのtopoII の発現低下の機序について,先のM期同調培養系を用いて検討した。まず,タンパク質合成阻害剤cycloheximide(CHX)とA23187とのtopoII の発現に対する影響を比較した。M期からrelease直後にCHX10 の発現に対する影響を比較した。M期からrelease直後にCHX10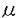 g/mlを培地中に添加し,topoII g/mlを培地中に添加し,topoII の発現量の経時変化を調べた。topoII の発現量の経時変化を調べた。topoII の発現量は,CHX添加によって徐々に低下し,12時間後にもとのレベルの約50%になった。CHXのタンパク質合成阻害を確認するため,c-mycタンパク質の発現に対する影響を調べた。c-mycはM期の細胞では発現していなくG1期に発現誘導されるが,CHXはこのc-mycの誘導を完全に抑制した。このことから,CHXによるtopoII の発現量は,CHX添加によって徐々に低下し,12時間後にもとのレベルの約50%になった。CHXのタンパク質合成阻害を確認するため,c-mycタンパク質の発現に対する影響を調べた。c-mycはM期の細胞では発現していなくG1期に発現誘導されるが,CHXはこのc-mycの誘導を完全に抑制した。このことから,CHXによるtopoII の発現低下は,タンパク質合成の阻害によるものと推察された。このCHXによるtopoII の発現低下は,タンパク質合成の阻害によるものと推察された。このCHXによるtopoII の低下に比べ,ストレスによるtopoII の低下に比べ,ストレスによるtopoII の低下は上述したように急激かつ顕著であり,12時間後にはもとのレベルの約20%になった。したがって,ストレスによるtopoII の低下は上述したように急激かつ顕著であり,12時間後にはもとのレベルの約20%になった。したがって,ストレスによるtopoII の発現低下には,topoII の発現低下には,topoII の合成の低下よりはむしろ分解の亢進が関与していることが示唆された。 の合成の低下よりはむしろ分解の亢進が関与していることが示唆された。 topoII の分解の亢進を確認するため,様々なprotease阻害剤の影響をM期同調培養系を用い調べた。その結果,proteasome inhibitorであるZ-Leu-Leu-Nva-H,Z-Ile-Glu(OBut)-Ala-Leu-HによってストレスによるtopoII の分解の亢進を確認するため,様々なprotease阻害剤の影響をM期同調培養系を用い調べた。その結果,proteasome inhibitorであるZ-Leu-Leu-Nva-H,Z-Ile-Glu(OBut)-Ala-Leu-HによってストレスによるtopoII の発現低下が抑制されることを見い出した。さらに,calpain inhibitor I (N-Ac-Leu-Leu-norleucinal)によっても抑制された。興味深いことに,calpain familyのproteaseに対してcalpain inhibitor Iと同程度の阻害活性を示すcalpain inhibitor II (N-Ac-Leu-Leu-normethioninal)は,topoII の発現低下が抑制されることを見い出した。さらに,calpain inhibitor I (N-Ac-Leu-Leu-norleucinal)によっても抑制された。興味深いことに,calpain familyのproteaseに対してcalpain inhibitor Iと同程度の阻害活性を示すcalpain inhibitor II (N-Ac-Leu-Leu-normethioninal)は,topoII の低下を抑制しなかった。また,leupeptin,TLCK,E64などのserineあるいはcysteine protease阻害剤もtopoII の低下を抑制しなかった。また,leupeptin,TLCK,E64などのserineあるいはcysteine protease阻害剤もtopoII の低下を抑制しなかった。 の低下を抑制しなかった。 以上の結果から,ストレスによるtopoII の発現低下には分解の亢進が関与しており,この分解にはproteasome inhibitorやcalpain inhibitor Iによって阻害される特異的なproteaseが関与していることが強く示唆された。 の発現低下には分解の亢進が関与しており,この分解にはproteasome inhibitorやcalpain inhibitor Iによって阻害される特異的なproteaseが関与していることが強く示唆された。 次に,topoII の分解が細胞内のどの部分で起こるかについて検討した。topoII の分解が細胞内のどの部分で起こるかについて検討した。topoII は核内に局在するタンパク質であるが,上記のprotease inhibitor処理によって分解を抑制した場合にもtopoII は核内に局在するタンパク質であるが,上記のprotease inhibitor処理によって分解を抑制した場合にもtopoII は核内に存在していた。したがって,topoII は核内に存在していた。したがって,topoII は,核外へ運び出されてから分解されるのではなく,核内で分解されるものと推察された。 は,核外へ運び出されてから分解されるのではなく,核内で分解されるものと推察された。 まとめ 本研究において私は,ヒト大腸癌HT-29細胞を用い,グルコース調節ストレスによるtopoII の発現低下が,ストレス応答した細胞のG1期に特異的に起こることを明らかにした。このtopoII の発現低下が,ストレス応答した細胞のG1期に特異的に起こることを明らかにした。このtopoII の発現低下には分解の亢進が重要であり、proteasome inhibitorに感受性のproteaseが関与しており,topoII の発現低下には分解の亢進が重要であり、proteasome inhibitorに感受性のproteaseが関与しており,topoII の分解を促進している可能性を示した。topoII の分解を促進している可能性を示した。topoII の発現低下は,抗癌剤への耐性化に直接結び付く変化であることから,ストレスによる耐性誘導にはproteolysisが重要な役割を果たしていることが示唆される。グルコース調節ストレス応答は,固形癌内部に特有の環境ストレスと密接に関連している細胞応答である。したがって,ストレスによるtopoII の発現低下は,抗癌剤への耐性化に直接結び付く変化であることから,ストレスによる耐性誘導にはproteolysisが重要な役割を果たしていることが示唆される。グルコース調節ストレス応答は,固形癌内部に特有の環境ストレスと密接に関連している細胞応答である。したがって,ストレスによるtopoII の分解の分子メカニズムの解明は,基礎的な興味だけではなく,固形癌に選択性のある化学療法剤の開発につながる可能性を秘めている。 の分解の分子メカニズムの解明は,基礎的な興味だけではなく,固形癌に選択性のある化学療法剤の開発につながる可能性を秘めている。 |
| 審査要旨 | | 固形癌の薬剤抵抗性は,癌化学療法の治療成績を著しく低下させる要因となっており,その分子機序の解明は新たな治療法の開発のために重要な課題である。固形癌では血管形成が異常なために,癌細胞は低酸素状態・栄養飢餓状態などの特殊な環境ストレスにさらされている。こうしたストレスに対する細胞応答としてグルコース調節ストレス応答がある。ストレス応答した癌細胞は,種々の抗癌剤に耐性を示すことから,このストレス応答は固形癌の耐性因子であると考えられる。本研究は,こうしたストレスによる耐性誘導に重要なDNA topoisomerase II (topoII (topoII )の発現低下とそのメカニズムを明らかにしたものである。 )の発現低下とそのメカニズムを明らかにしたものである。 以下,研究結果の要旨を記す。 1.ストレスによるtopoII の発現低下と細胞周期 の発現低下と細胞周期 グルコース調節ストレス応答した細胞では,GRPと呼ばれる一群のストレスタンパク質が発現誘導される。ヒト大腸癌HT-29細胞をストレスインデューサーのカルシウムイオノフォアA23187(1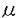 M)で24時間処理すると,GRP78の発現量が3〜4倍程度増大し,ストレス応答が確認された。このGRP78の発現誘導に伴い,topoII阻害剤VP-16,Adriamycinの耐性が誘導され,topoII M)で24時間処理すると,GRP78の発現量が3〜4倍程度増大し,ストレス応答が確認された。このGRP78の発現誘導に伴い,topoII阻害剤VP-16,Adriamycinの耐性が誘導され,topoII の発現量が著しく低下した。また,FACS解析の結果,A23187処理によって細胞周期はG1期に停止することが明らかになった。 の発現量が著しく低下した。また,FACS解析の結果,A23187処理によって細胞周期はG1期に停止することが明らかになった。 2.G1期に特異的なtopoII の発現低下 の発現低下 ストレスによるtopoII の発現低下と細胞周期のG1期停止との関係を明らかにするため,M期の進行を特異的に阻害するnocodazoleを用い検討した。nocodazole存在下では,ストレスによるGRP78の発現誘導は起こるが,細胞周期はG1期には入らずM期で停止していた。これは,nocodazoleによるM期停止に伴い,G1期への進行が抑制されるためと理解された。このM期に停止した細胞ではtopoII の発現低下と細胞周期のG1期停止との関係を明らかにするため,M期の進行を特異的に阻害するnocodazoleを用い検討した。nocodazole存在下では,ストレスによるGRP78の発現誘導は起こるが,細胞周期はG1期には入らずM期で停止していた。これは,nocodazoleによるM期停止に伴い,G1期への進行が抑制されるためと理解された。このM期に停止した細胞ではtopoII の発現低下も起こらなかった。そこで,nocodazoleを培地中から除くことによってM期停止を解除し,ストレスによるG1期でのtopoII の発現低下も起こらなかった。そこで,nocodazoleを培地中から除くことによってM期停止を解除し,ストレスによるG1期でのtopoII の発現低下の可能性を検討した。A23187未処理のcontrol細胞では,M期停止の解除後,培養時間依存的にG1期の細胞の割合が増加し6時間後にピークに達した。9時間後にはS期の細胞の割合がピークとなり,細胞周期はM期からS期にかけて同調的に進行した。一方,A23187処理によりストレス応答した細胞では,M期からG1期への進行はcontrol細胞とほぼ同様に起こるが,G1期からS期への進行は抑制されG1期停止が確認された。このとき,topoII の発現低下の可能性を検討した。A23187未処理のcontrol細胞では,M期停止の解除後,培養時間依存的にG1期の細胞の割合が増加し6時間後にピークに達した。9時間後にはS期の細胞の割合がピークとなり,細胞周期はM期からS期にかけて同調的に進行した。一方,A23187処理によりストレス応答した細胞では,M期からG1期への進行はcontrol細胞とほぼ同様に起こるが,G1期からS期への進行は抑制されG1期停止が確認された。このとき,topoII の発現量を調べると,control細胞ではM期からS期にかけて一定であった。一方,ストレス応答した細胞では,M期から6時間後まではtopoII の発現量を調べると,control細胞ではM期からS期にかけて一定であった。一方,ストレス応答した細胞では,M期から6時間後まではtopoII の発現量は一定であったが,9時間以降に急激に低下した。M期から6時間後には,細胞周期はG1期に進行していることから,ストレスによるtopoII の発現量は一定であったが,9時間以降に急激に低下した。M期から6時間後には,細胞周期はG1期に進行していることから,ストレスによるtopoII の発現低下はG1期に特異的に起こることが明らかになった。 の発現低下はG1期に特異的に起こることが明らかになった。 3.ストレスによるtopoII の分解の亢進 の分解の亢進 ストレスによるtopoII の発現低下の機序について,先のM期同調培養系を用いて検討した。タンパク質合成阻害剤cycloheximide(CHX)とA23187とのtopoII の発現低下の機序について,先のM期同調培養系を用いて検討した。タンパク質合成阻害剤cycloheximide(CHX)とA23187とのtopoII の発現に対する影響を比較したところ,タンパク質合成阻害によるtopoII の発現に対する影響を比較したところ,タンパク質合成阻害によるtopoII の低下に比べ,ストレスによるtopoII の低下に比べ,ストレスによるtopoII の低下は急激かつ顕著であった。このことから,ストレスによるtopoII の低下は急激かつ顕著であった。このことから,ストレスによるtopoII の発現低下には,合成の低下よりはむしろ分解の亢進が関与していることが示唆された。topoII の発現低下には,合成の低下よりはむしろ分解の亢進が関与していることが示唆された。topoII の分解の亢進を確認するため,様々なprotease阻害剤の影響を調べた。その結果,proteasome阻害剤のZ-Leu-Leu-Nva-H,Z-Ile-Glu(OBut)-Ala-Leu-Hが,ストレスによるtopoII の分解の亢進を確認するため,様々なprotease阻害剤の影響を調べた。その結果,proteasome阻害剤のZ-Leu-Leu-Nva-H,Z-Ile-Glu(OBut)-Ala-Leu-Hが,ストレスによるtopoII の発現低下を抑制することを見い出した。一方,proteasomeを阻害しないleupeptin,TLCK,E64などの代表的なserineあるいはcysteine protease阻害剤はtopoII の発現低下を抑制することを見い出した。一方,proteasomeを阻害しないleupeptin,TLCK,E64などの代表的なserineあるいはcysteine protease阻害剤はtopoII の低下を抑制しなかった。以上の結果から,ストレスによるtopoII の低下を抑制しなかった。以上の結果から,ストレスによるtopoII の発現低下には分解の亢進が関与しており,proteasomeの関与が強く示唆された。 の発現低下には分解の亢進が関与しており,proteasomeの関与が強く示唆された。 以上のように本研究は,グルコース調節ストレスによるtopoII の発現低下がストレス応答した癌細胞のG1期に特異的に起こることを明らかにし,このtopoII の発現低下がストレス応答した癌細胞のG1期に特異的に起こることを明らかにし,このtopoII の発現低下にはproteasomeによる分解が関与している可能性を示したものである。グルコース調節ストレス応答は,固形癌内部に特有の環境ストレスと密接に関連している細胞応答である。したがって,ストレスによるtopoII の発現低下にはproteasomeによる分解が関与している可能性を示したものである。グルコース調節ストレス応答は,固形癌内部に特有の環境ストレスと密接に関連している細胞応答である。したがって,ストレスによるtopoII の分解の分子メカニズムの解明は,基礎的な興味だけではなく,固形癌に選択性のある化学療法剤の開発につながる可能性を秘めており,今後の発展が期待される。本研究は,臨床上重要な固形癌の薬剤耐性機構の解明に寄与するところ大きく,博士(薬学)の学位に値するものと判断した。 の分解の分子メカニズムの解明は,基礎的な興味だけではなく,固形癌に選択性のある化学療法剤の開発につながる可能性を秘めており,今後の発展が期待される。本研究は,臨床上重要な固形癌の薬剤耐性機構の解明に寄与するところ大きく,博士(薬学)の学位に値するものと判断した。 |