本研究はヒト単球をCSFで分化誘導して得たマクロファージと肺胞マクロファージの細胞の生死に関する機構を解析したものであり、下記の結果を得ている。 1.M-CSFで分化誘導したマクロファージ(M-M )は過酸化水素(H2O2)に感受性が高く、GM-CSFで分化誘導したマクロファージ(GM-M )は過酸化水素(H2O2)に感受性が高く、GM-CSFで分化誘導したマクロファージ(GM-M )及び肺胞マクロファージ(A-M )及び肺胞マクロファージ(A-M )はH2O2に感受性が低く、両者の感受性の差は約100倍に達した。 )はH2O2に感受性が低く、両者の感受性の差は約100倍に達した。 2.CSFを除いた培地で培養した場合、M-M にのみ細胞死を認め、GM-M にのみ細胞死を認め、GM-M とA-M とA-M は生存した。 は生存した。 3.GM-M とA-M とA-M より得た培養上清を添加するとCSFを除いた後もM-M より得た培養上清を添加するとCSFを除いた後もM-M は細胞死を免れた。 は細胞死を免れた。 4.培養上清を抗カタラーゼ抗体で中和後M-M に添加した場合に、培養上清は細胞を救済する活性を失い、CSFを含まない培地にカタラーゼを添加することによりM-M に添加した場合に、培養上清は細胞を救済する活性を失い、CSFを含まない培地にカタラーゼを添加することによりM-M は細胞死を免れたことから、GM-M は細胞死を免れたことから、GM-M とA-M とA-M より得た培養上清中の活性はカタラーゼによるものと考えられた。 より得た培養上清中の活性はカタラーゼによるものと考えられた。 5.M-M の救済に対してSOD,PDGF の救済に対してSOD,PDGF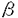 および還元型チオール化合物は、カタラーゼと比較して重要ではないことを示した。 および還元型チオール化合物は、カタラーゼと比較して重要ではないことを示した。 6.CSFを加えた培地で培養したGM-M とA-M とA-M においても、抗カタラーゼ抗体の添加により細胞死を認めたことから、培養上清中に存在するカタラーゼはGM-M においても、抗カタラーゼ抗体の添加により細胞死を認めたことから、培養上清中に存在するカタラーゼはGM-M とA-M とA-M の生存にも重要な役割を演じていると考えられた。 の生存にも重要な役割を演じていると考えられた。 7.細胞内でのカタラーゼ活性およびカタラーゼmRNA発現はGM-M とA-M とA-M で高くM-M で高くM-M で低かった。これに対して、細胞内でのSOD活性およびCu/Zn-SODmRNA発現は、M-M で低かった。これに対して、細胞内でのSOD活性およびCu/Zn-SODmRNA発現は、M-M で高くGM-M で高くGM-M とA-M とA-M で低かった。この事実はGM-M で低かった。この事実はGM-M とA-M とA-M はH2O2の消去に優れ、一方M-M はH2O2の消去に優れ、一方M-M はH2O2の消去に劣ることを示していた。 はH2O2の消去に劣ることを示していた。 8.M-CSFを除いた培地で培養したM-M の細胞死と培地に抗カタラーゼ抗体を添加して誘導されるGM-(A-)M の細胞死と培地に抗カタラーゼ抗体を添加して誘導されるGM-(A-)M の細胞死は組織化学的な検索からアポトーシスであることが示された。 の細胞死は組織化学的な検索からアポトーシスであることが示された。 以上、本論文では、M-M はGM-M はGM-M と比較してH2O2やTNF と比較してH2O2やTNF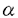 ,IL-1等の炎症性サイトカインを放出しやすいばかりでなく、H2O2に対して耐性能力が低いこと、一方GM-M ,IL-1等の炎症性サイトカインを放出しやすいばかりでなく、H2O2に対して耐性能力が低いこと、一方GM-M 及びA-M 及びA-M は刺激によるH2O2や炎症性サイトカインの産生能力が低いことに加えて、H2O2に対して耐性能力が高いこと、その機構にはカタラーゼが深く関わっていることを明らかにしている。本論文はM は刺激によるH2O2や炎症性サイトカインの産生能力が低いことに加えて、H2O2に対して耐性能力が高いこと、その機構にはカタラーゼが深く関わっていることを明らかにしている。本論文はM の誘導法の違いにより活性酸素に対する感受性が異なることを見い出し、その機構を解明したもので、活性酸素による肺組織障害を理解するうえで重要な貢献を果たしていると考えられ、学位の授与に値すると考えられる。 の誘導法の違いにより活性酸素に対する感受性が異なることを見い出し、その機構を解明したもので、活性酸素による肺組織障害を理解するうえで重要な貢献を果たしていると考えられ、学位の授与に値すると考えられる。 |