| 内容要旨 | | 【諸言】 3’-azido-3’-deoxythymidine(AZT)は、2’,3’-dideoxyinosine(DDI)と共に抗HIV薬として用いられているが、脳炎治療の作用点となる中枢神経系への移行は制限されている.すなわち、偽定常状態に於ける脳脊髄液(CSF)/血漿中濃度比は、AZTで0.15、DDIで0.02と極めて低いことが報告されている.一方、両化合物のこの比の値は、 probenecid併用により有意に増大することから、中枢と循環血のinterfaceとなる血液脳関門(BBB),血液脳脊髄液関門(BCSFB)は、単に血液から中枢へのligandのinfluxを制限しているのみでなく、中枢から血液への排出にも関与する可能性が示唆されている.実際BCSFBを形成する脈絡叢上皮細胞は、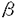 -lactam抗生物質をはじめとする、種々有機アニオン系化合物を能動的に脳脊髄液から汲み出す能力を備えていることが報告されている1).また、BBBに於いても、AZTがprobenecid感受性の機能により、脳から血液側へと輸送されることを示唆する報告もなされている.そこで、本研究ではAZT,DDIの各関門に於ける輸送系をcharacteraizeし、循環血内投与後の中枢分布性の差異を定量的に評価することを目的とし、以下の検討を加えた. -lactam抗生物質をはじめとする、種々有機アニオン系化合物を能動的に脳脊髄液から汲み出す能力を備えていることが報告されている1).また、BBBに於いても、AZTがprobenecid感受性の機能により、脳から血液側へと輸送されることを示唆する報告もなされている.そこで、本研究ではAZT,DDIの各関門に於ける輸送系をcharacteraizeし、循環血内投与後の中枢分布性の差異を定量的に評価することを目的とし、以下の検討を加えた. 【方法】a)脈絡叢に於ける輸送系の解析 常法に従い、rat側脳室より脈絡叢を単離し1)、[3H]AZT,[3H]DDIの輸送、さらに[3H]benzylpenicillin([3H]PCG)に対するAZT,DDIの効果について検討した. b)Brain Efflux Index(BEI)法を用いたBBB排出輸送系の解析 イヌリンをimpermeable referenceとして用い、rat大脳Par2にmicroinjectionし、一定時間後ratを屠殺し、脳内残存する放射活性を測定した.BBB排出能力を次のBEI値を用いて評価した.  投与後の時間に対して薬物残存率,(100-BEI)値をplotし、得られた傾きから、efflux rate constant(kel)を、さらにその値にin vitroのslice uptake studyから見積った脳分布容積(Vbr)を乗じて、BBBにおけるefflux clearance(PSeff)を算出した. c)Distributed modelを用いた脳内分布の速度論的解析 AZT,DDIの中枢分布性の差異を定量的に評価するため、血液,脳細胞間液(ISF),CSF間のligand exchangeを考慮に入れた、physiologically based pharmacokinetic model(distributed model)を構築し、以下の物質収支式と境界条件を用いて薬物の中枢内動態を解析した.なお、このmodelに従った場合、静脈内(iv)投与後のCbr(x,t)は次の式により与えられる. 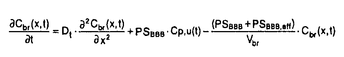 ここで initial conditionは:Cbr(x,0)=0 boundary conditionは:at x=0 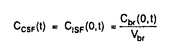 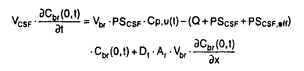 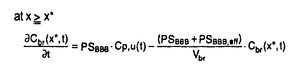 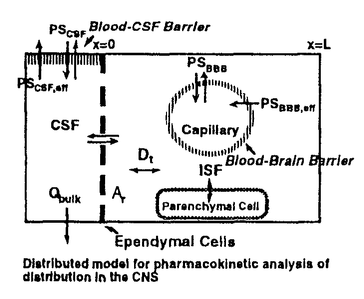 図表 図表 Cp,u(t)は血漿中非結合型濃度、Dtは脳中拡散定数、Cbr(x,t)はCSF表層からの距離xの点に於ける脳中濃度、PSBBB,PSBBB,effはBBBを介する対称性の透過クリアランス、及び特異的な輸送系による排出クリアランス、PSCSF,PSCSF,effはBCSFBを介する対称性の透過クリアランス、及び特異的な輸送系による排出クリアランス、CCSFはCSF中濃度、CISFはISF中濃度及びVbrは脳分布容積を示す. 以上の方程式からラプラス変換解を求め、高速逆ラプラス変換-最小二乗法プログラム(MULTI-FILT)により、実測値に対するfittingを行なった.脳室内(icv)投与後のデータに対しても同様な解析を行なった.実測値は[3H]AZT,[3H]DDIをratにiv投与後の脳中,CSF中濃度、及びicv投与後のCSF中濃度のtime courseを用いた.計算に当たり、Ar(ependymal surface area),Qbulk(bulk flowの流速),VCSF(CSFの容積)及びDtは文献値を用いた.初期値は、PSBBB,PSCFSはintegration plot、PSBBB,effはBEI法、PSCSF,effはicv投与の結果を用いた. 【結果・考察】a)脈絡叢に於ける排出輸送系 脈絡叢に於ける有機アニオン輸送系の典型的な基質となる1)[3H]PCGの輸送は、AZT(Ki=85±13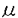 M)、DDI(Ki=155±22 M)、DDI(Ki=155±22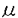 M)により競合的に阻害され、AZT,DDIは本輸送系により認識されることが示された.[3H]DDIの輸送は飽和性を示し(Km=30±5 M)により競合的に阻害され、AZT,DDIは本輸送系により認識されることが示された.[3H]DDIの輸送は飽和性を示し(Km=30±5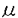 M)、代謝阻害剤(carbonylcyanide p-trifluoromethoxyphenyl hydrazone,rotenone)、SH基修飾剤(p-chloromercuribenzoic acid,p-chloromercuribenzenesulfonic acid)により阻害されたが、外液のNa+をN-methyl-D-glucamineに置換しても影響を受けず、Na+非依存性の能動輸送が示された.[3H]AZTの取り込みは殆ど観察されず、AZTはこの輸送系により認識されるものの、輸送は受けないことが示唆された. M)、代謝阻害剤(carbonylcyanide p-trifluoromethoxyphenyl hydrazone,rotenone)、SH基修飾剤(p-chloromercuribenzoic acid,p-chloromercuribenzenesulfonic acid)により阻害されたが、外液のNa+をN-methyl-D-glucamineに置換しても影響を受けず、Na+非依存性の能動輸送が示された.[3H]AZTの取り込みは殆ど観察されず、AZTはこの輸送系により認識されるものの、輸送は受けないことが示唆された. 単離脈絡叢を用いた実験結果をin vivoへ外挿すると、AZTのCSFからの消失クリアランスは、CSFのbulk flow rate(2.9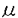 l/min)と等しいのに対し、DDIはAZTの約2倍(5.6 l/min)と等しいのに対し、DDIはAZTの約2倍(5.6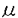 l/min)と見積られ、iv投与後のCSF移行性の約7倍の差は脈絡叢を介した汲み出しの差のみでは説明できなかった. l/min)と見積られ、iv投与後のCSF移行性の約7倍の差は脈絡叢を介した汲み出しの差のみでは説明できなかった. b)[3H]AZT,[3H]DDIのBBBを介した排出 [3H]AZT,[3H]DDIは脳内直接投与後それぞれ半減期20,30minでkel=0.0317,0.0253min-1で消失した.また、Vbrは、1.07,0.727ml/g brainと求められ、AZT,DDIの排出クリアランスはそれぞれ34,18.5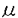 l/min/g brainと算出された. l/min/g brainと算出された. AZTの輸送は、Km=4.28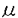 M,Vmax=59.8pmol/min/g brainの飽和性を有する部分と、PSdiff=25.4 M,Vmax=59.8pmol/min/g brainの飽和性を有する部分と、PSdiff=25.4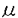 l/min/g brainにより表わされる非飽和性の部分から成っていた.同様に、probenecid33 l/min/g brainにより表わされる非飽和性の部分から成っていた.同様に、probenecid33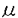 M以上の濃度で有為な阻害効果がみられた.またチミジンにより阻害は見られないものの、DDI,p-aminohippuric acid,PCG及び4,4’-diisothiocyanatostilbene-2,2’-disulfonic acid等有機アニオン輸送系の基質により有為に阻害され、AZTのBBBを介した排出の約40%は有機アニオン輸送系を介した排出系であることが示唆された. M以上の濃度で有為な阻害効果がみられた.またチミジンにより阻害は見られないものの、DDI,p-aminohippuric acid,PCG及び4,4’-diisothiocyanatostilbene-2,2’-disulfonic acid等有機アニオン輸送系の基質により有為に阻害され、AZTのBBBを介した排出の約40%は有機アニオン輸送系を介した排出系であることが示唆された. 同様に、DDIの輸送は、Km=11.3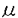 M,Vmax=85.9pmol/min/g brainの飽和性を有する部分と、PSdiff=7.05 M,Vmax=85.9pmol/min/g brainの飽和性を有する部分と、PSdiff=7.05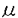 l/min/g brainにより表わされる非飽和性の部分から成っており、約60%が飽和性の排出過程に依ることが示された.deoxyinosine,inosineによる阻害はみられず、AZT,probenecidにより阻害され、AZTと同様、probenecid感受性の輸送系により排出されることが示唆された. l/min/g brainにより表わされる非飽和性の部分から成っており、約60%が飽和性の排出過程に依ることが示された.deoxyinosine,inosineによる阻害はみられず、AZT,probenecidにより阻害され、AZTと同様、probenecid感受性の輸送系により排出されることが示唆された. さらに、脳中及び頚静脈中の標識体をHPLCで分離した結果、ほぼ90%以上のisotope体が未変化体として検出されたことから、脳からのisotopeの減少は未変化体の排出過程を反映することが示された. C)脳実質組織及びCSF中分布性の解析 AZT,DDIをiv投与後10minまでの血漿中,脳中,CSF中濃度profileをFig.1a,b,c,Fig.2a,b,cに示す.同様にFig.1d,Fig.2dは両化合物をicv投与後のCSF中濃度推移を示す.得られたdataをdistributed modelに従って解析し、fitted lineは図中のsolid lineで示した.良好なfittingが得られ、modelの妥当性が示唆された.得られたparameter値から、steady stateに於ける脳/血漿,CSF/血漿中濃度比を計算すると、AZTに対しては、0.12,0.14、DDIに対しては0.057,0.027となり、報告値とほぼ一致した. PSBBB,effはPSBBBに比べ、AZT,DDIでそれぞれ20倍,40倍大きく、AZT,DDIの中枢分布が制限されている原因の1つとして、特異的な輸送系による排出過程が大きな寄与を示していることが明らかとなった. 以上の結果より、AZT及びDDIは、BBBに於いても、中枢側から循環血液側にprobenecid感受性の機構により排出されることが明らかになった.この排出輸送系は、両化合物の脳内分布性を顕著に制限していることから、BBBの排出輸送系に対する親和性を低下させることによっても、脳内移行性を改善できる可能性が示された. 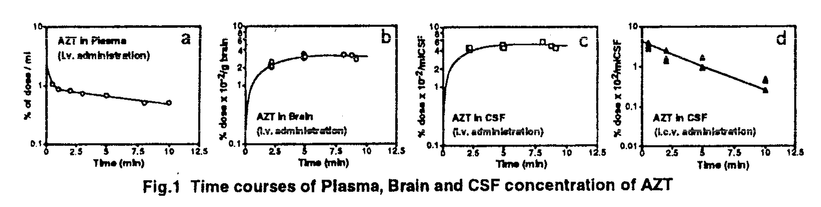 Fig.1 Time courses of Plasma,Brain and CSF concentration of AZT Fig.1 Time courses of Plasma,Brain and CSF concentration of AZT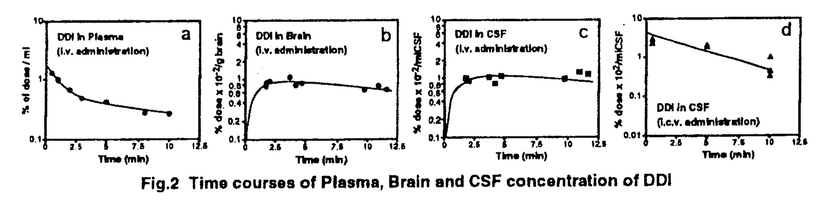 Fig.2 Time courses of Plasma,Brain and CSF concentration of DDI【reference】1)Ogawa,M.,Suzuki,H.,Sawada,Y.,Hanano,M.and Sugiyama,Y.:Am.J.Physiol.266,R392-R399,1994. Fig.2 Time courses of Plasma,Brain and CSF concentration of DDI【reference】1)Ogawa,M.,Suzuki,H.,Sawada,Y.,Hanano,M.and Sugiyama,Y.:Am.J.Physiol.266,R392-R399,1994. |