| 序論 マイトトキシン(maitotoxin,MTX)は、渦鞭毛藻Gambierdiscus toxicusの生産する分子量3422の海洋天然物であり、その化学構造は高分解能核磁気共鳴スペクトル、タンデム質量分析、及び立体化学については合成化学的手法を用いて、1996年にその絶対構造を含めた全構造が決定された(図1)。MTXは南方海域で発生する食中毒シガテラの原因毒の一つとして発見され、そのマウス致死毒性はフグ毒テトロドトキシンの2,000倍(15pmol/kg ip)にも達し、少数のタンパク毒を除くと現在知られる最強の有毒物質である。またMTXは広範囲の動物細胞に対して顕著なカルシウム流入を誘起し、これに伴ってホスファチジルイノシトールの加水分解、神経伝達物質の放出、骨格筋収縮など多岐にわたる生理作用をもたらすことが報告されている。しかし、これらの生理活性について20年近くにわたり数多くの報告がなされているものの、カルシウム流入に至る作用機序は未解明である。 著者は本研究科において、作用標的分子の同定を含むMTXの作用機序解明を目的として、放射性カルシウム同位体を用いたMTXのカルシウム流入作用に対する阻害剤の探索(第一章)と、MTXの細胞膜表面での糖鎖認識に関する研究(第二章)を行い、いくつかの重要な知見を得た。 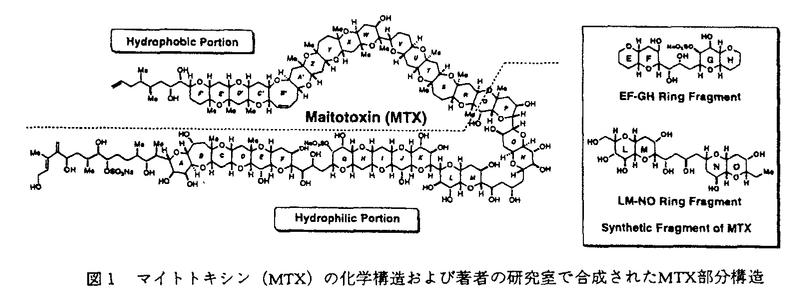 図1 マイトトキシン(MTX)の化学構造および著者の研究室で合成されたMTX部分構造第一章:MTXのカルシウム流入作用に対する新規阻害剤の探索 図1 マイトトキシン(MTX)の化学構造および著者の研究室で合成されたMTX部分構造第一章:MTXのカルシウム流入作用に対する新規阻害剤の探索 (1)疎水性アミン:電位依存性カルシウムチャンネル(Voltage-Sensitive Calcium Channels,VSCC)の阻害剤であるジルチアゼム、ベラパミル、ニフェジピンをはじめ、既知のMTX阻害剤の多くは疎水性アミンである。これら阻害剤のVSCC以外への作用での寄与を調べるため、2種類のイオンチャンネル(遅延整流性カリウムチャンネルおよびカルシウム依存性カリウムチャンネル)のみの発現が報告されているラットグリオーマC6細胞を用い、MTXのカルシウム流入作用に対する阻害効果を調べた。 その結果、ジルチアゼム(IC50=50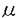 M)およびベラパミル(IC50=50 M)およびベラパミル(IC50=50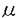 M)は、VSCCに対しての阻害濃度よりもかなり高い濃度では阻害活性を示した。また単純な疎水性アミとしてヘキシルアミン類をもちいて阻害活性試験を行った結果、モノヘキシルアミンは阻害作用を示さない一方、ジヘキシルアミン(IC50=50 M)は、VSCCに対しての阻害濃度よりもかなり高い濃度では阻害活性を示した。また単純な疎水性アミとしてヘキシルアミン類をもちいて阻害活性試験を行った結果、モノヘキシルアミンは阻害作用を示さない一方、ジヘキシルアミン(IC50=50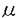 M)、トリヘキシルアミン(IC50=20 M)、トリヘキシルアミン(IC50=20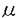 M)、ヨウ化テトラヘキシルアンモニウム(IC50=5 M)、ヨウ化テトラヘキシルアンモニウム(IC50=5 M)は、ヘキシル基の数の増加に伴いMTXによるカルシウム流入を顕著に阻害した(図2)。ヨウ化テトラヘキシルアンモニウムは遅延整流性カリウムチャンネルの阻害剤として知られているが、このチャンネルの強力な阻害剤であるカリブドトキシンはMTXの作用を阻害しなかった。 M)は、ヘキシル基の数の増加に伴いMTXによるカルシウム流入を顕著に阻害した(図2)。ヨウ化テトラヘキシルアンモニウムは遅延整流性カリウムチャンネルの阻害剤として知られているが、このチャンネルの強力な阻害剤であるカリブドトキシンはMTXの作用を阻害しなかった。  図2 ヘキシルアミン類によるMTX(1nM)作用の阻害 図2 ヘキシルアミン類によるMTX(1nM)作用の阻害 やはり疎水性アミンであるベラトリジン(IC50=10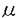 M)、バトラコトキシン(IC50=5 M)、バトラコトキシン(IC50=5 M)はヨウ化テトラヘキシルアンモニウムとほぼ同程度の強さでMTXの作用を阻害した。これらの化合物は電位依存性ナトリウムチャンネル(Voltage-Sensitive Sodium Channel,VSSC)に作用する神経毒として知られているが、この阻害作用はVSSCの強力な阻害剤として知られるテトロドトキシン(tetrodotoxin,TTX)の影響を受けなかった。以上の結果より、疎水性アミンに親和性を示す新しいタイプのイオンチャンネルにMTXが結合し、活性を発現している可能性が考えられる。 M)はヨウ化テトラヘキシルアンモニウムとほぼ同程度の強さでMTXの作用を阻害した。これらの化合物は電位依存性ナトリウムチャンネル(Voltage-Sensitive Sodium Channel,VSSC)に作用する神経毒として知られているが、この阻害作用はVSSCの強力な阻害剤として知られるテトロドトキシン(tetrodotoxin,TTX)の影響を受けなかった。以上の結果より、疎水性アミンに親和性を示す新しいタイプのイオンチャンネルにMTXが結合し、活性を発現している可能性が考えられる。 (2)梯子状ポリエーテル:MTXと同様に環状エーテルが梯子状に縮環した構造を有し、強い生理活性を示す化合物は他にも幾つか知られているが、個々の生理活性は多岐にわたり、梯子状ポリエーテル化合物に共通する分子認識機構は知られていない。そこで、梯子状ポリエーテル化合物に親和性を示す疎水性タンパク領域が膜タンパク質上に存在すると想定し、こうしたポリエーテル化合物の一つであるブレベトキシンB(PbTx2)の競合結合によるMTXに対する阻害活性を調べることにより、この作業仮説を検証した。まず、MTXの結合阻害についてトリチウム標識された水素添加MTX([3H]H-MTX)を用いてラット脳シナプトソームに対する競合結合試験を行ったが、[3H]H-MTXの容器などへの非特異的吸着のため特異的な競合結合阻害を観測できなかった。またブレベトキシンB(PbTx2)のアルデヒドをCeCl3存在下[3H]NaBH4で還元して得られた[3H]PbTx3を用いて同様な結合試験を行ったが、MTXによる結合阻害は観測されなかった。 そこで、MTXのカルシウム流入作用に対する阻害によりPbTx2の競合結合を評価した。この結果、MTXのカルシウム流入作用はPbTx2により濃度依存的に抑制され(IC50=20 M、図3a)、類縁体のPbTx1もほぼ同様な阻害活性を持つことが示された(図3b)。これらの阻害作用はPbTx2の標的分子とされるVSSCの特異的阻害剤であるTTX存在下においても同様に観測され、PbTx2がVSSC以外の膜結合タンパク質にも親和性を持つことが示された。ただし、PbTx2の阻害濃度はMTXのおよそ10,000倍であり、その受容体に対するPbTx2の結合親和性はMTXと比較した場合、それ程強くはない。 M、図3a)、類縁体のPbTx1もほぼ同様な阻害活性を持つことが示された(図3b)。これらの阻害作用はPbTx2の標的分子とされるVSSCの特異的阻害剤であるTTX存在下においても同様に観測され、PbTx2がVSSC以外の膜結合タンパク質にも親和性を持つことが示された。ただし、PbTx2の阻害濃度はMTXのおよそ10,000倍であり、その受容体に対するPbTx2の結合親和性はMTXと比較した場合、それ程強くはない。 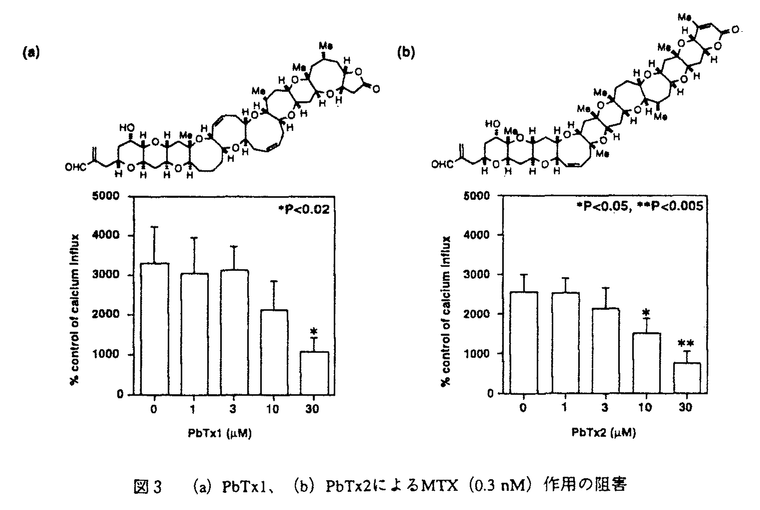 図3 (a)PbTx1、(b)PbTx2によるMTX(0.3nM)作用の阻害第二章 図3 (a)PbTx1、(b)PbTx2によるMTX(0.3nM)作用の阻害第二章 MTXは図1に示すように、分子内に硫酸エステルや水酸基が集中する親水性領域と、生体膜への親和性が高い疎水性ポリエーテル領域の両方を有する両親媒性化合物である。上記のPbTx2と競合する疎水性部分が細胞膜に結合する一方、親水性部分は細胞膜の外表面で、標的分子の親水性領域と結合することが予想される。このような親水性標的部分として細胞表面に豊富に存在する糖鎖を想定し、MTXによるこうした糖鎖認識を検証するため、(1)細胞表面からの糖鎖の除去、および(2)細胞表面に新たな糖鎖の移植を行い、MTXの活性に対する影響を調べた。 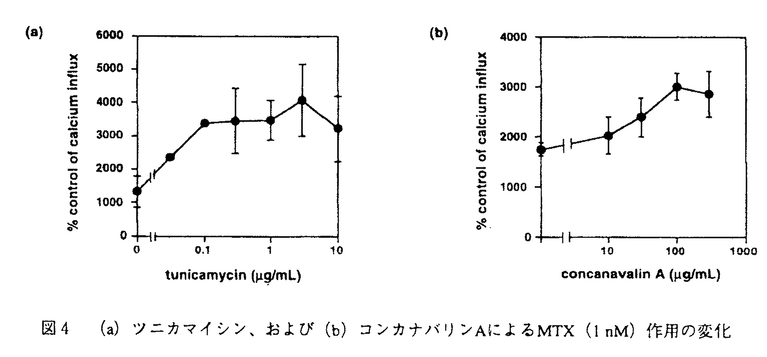 図4 (a)ツニカマイシン、および(b)コンカナバリンAによるMTX(1nM)作用の変化 図4 (a)ツニカマイシン、および(b)コンカナバリンAによるMTX(1nM)作用の変化 まず、ラットグリオーマC6細胞をN-アスパラギン結合型糖鎖の発現を抑えるツニカマイシンで19時間処理すると、MTX(1nM)によるカルシウム流入活性はツニカマイシンの濃度に依存して増加した。また、細胞表面の糖鎖に結合親和性を有するレクチンの一種コンカナバリンAを作用させることによっても、MTXによるカルシウム流入活性が顕著に増加した。これらの結果は糖鎖の除去、或いは糖鎖のキャッピングが行われた結果、MTXの非特異的結合が減少し活性が増加したと解釈され、すなわち細胞表面に存在する標的分子以外の糖鎖がMTXの活性発現を阻害することを意味する。 糖脂質であるモノシアロガングリオシド(モノシアロGM1)がMTXの大動脈内皮細胞に対するカルシウム流入作用を抑制することは既に報告されていたが、ここでの糖鎖の寄与については不明であり、今回、他のガングリオシドを含めた糖脂質のMTX作用に対する阻害作用をC6細胞を用いて検討した。その結果、モノシアロGM1(IC50=3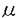 M)>モノシアロGM3(IC50=5 M)>モノシアロGM3(IC50=5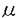 M)>アシアロGM1(IC50=20 M)>アシアロGM1(IC50=20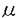 M)の順で阻害活性を示した。モノシアロGM3とアシアロGM1の活性の差より、シアル酸の寄与が重要であると考えられる。糖鎖を欠くセラミドは阻害活性を示さず、細胞膜に再構成されたガングリオシドの糖鎖がMTXの活性発現を阻害することが明らかとなった。 M)の順で阻害活性を示した。モノシアロGM3とアシアロGM1の活性の差より、シアル酸の寄与が重要であると考えられる。糖鎖を欠くセラミドは阻害活性を示さず、細胞膜に再構成されたガングリオシドの糖鎖がMTXの活性発現を阻害することが明らかとなった。 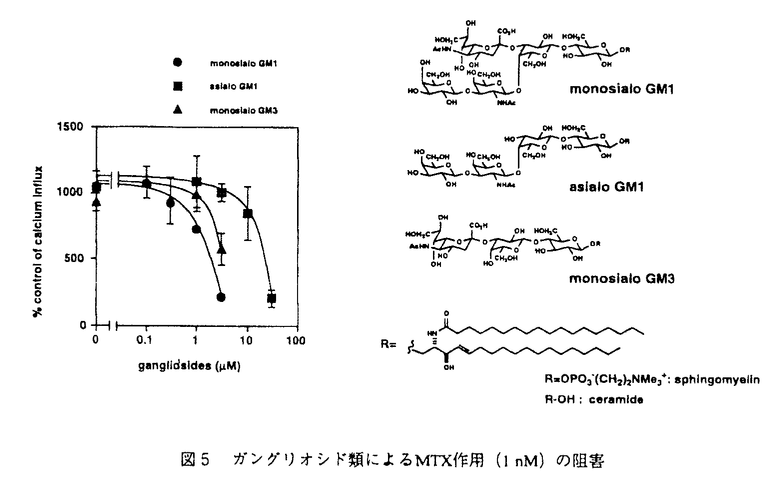 図5 ガングリオシド類によるMTX作用(1nM)の阻害 図5 ガングリオシド類によるMTX作用(1nM)の阻害 一方、リン脂質であるホスファチジルコリン(IC50=20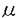 M)、スフィンゴミエリン(IC50=20 M)、スフィンゴミエリン(IC50=20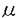 M)などは糖鎖を有しないにもかかわらず阻害活性を示したが、これは膜に対する親和性が高いこれらリン脂質が細胞表面を被覆し、MTXの結合を抑制した結果であると考えられる。 M)などは糖鎖を有しないにもかかわらず阻害活性を示したが、これは膜に対する親和性が高いこれらリン脂質が細胞表面を被覆し、MTXの結合を抑制した結果であると考えられる。 また、著者の研究室で合成されたMTXのEF-GH環部フラグメント(図1)は、MTXと逆の絶対立体配置を持つにもかかわらず濃度依存的に阻害活性(IC50=200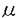 M)を示し、この位置におけるMTXの脱硫酸体の活性が大きく低下することに対応して、G環部の硫酸エステル部分を欠くアルコール体は阻害活性を示さなかった。同様に著者の研究室で合成されたLM-NO環部フラグメントも濃度依存的に阻害活性(IC50=500 M)を示し、この位置におけるMTXの脱硫酸体の活性が大きく低下することに対応して、G環部の硫酸エステル部分を欠くアルコール体は阻害活性を示さなかった。同様に著者の研究室で合成されたLM-NO環部フラグメントも濃度依存的に阻害活性(IC50=500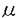 M)を示したが、これら二つのフラグメントと同程度の大きさをもつ親水性化合物(ラクトース、ラフィノースなど)は阻害活性を示さなかった。以上より、これらの合成フラグメントがMTXと結合部位を競合することが示唆された。 M)を示したが、これら二つのフラグメントと同程度の大きさをもつ親水性化合物(ラクトース、ラフィノースなど)は阻害活性を示さなかった。以上より、これらの合成フラグメントがMTXと結合部位を競合することが示唆された。 |