| 内容要旨 | | [研究目的および背景] 瀘胞性リンパ腫は,瀘胞構造が正常二次リンパ器官における瀘胞構造に相似することから,胚中心(germinal center;GC)のB細胞由来であり,免疫グロブリン(immunoglobulin;Ig)産生腫瘍と考えられてきた。またこのリンパ腫は一方のアレルで高率(約90%)に,t(14;18)染色体転座が生じ,その結果,bcl-2遺伝子がIg遺伝子のenhancerの支配下となることにより,その発現がup-regulateされる。そしてB細胞のアポトーシス(apoptosis)がブロックされ,不死化することが報告されている(Hockenbergら,1990)。 最近,Nganら(1989)よって,一部の瀘胞性リンパ腫は,Ig非産生であることが報告された。彼等の解析によると,これらIg非産生瀘胞性リンパ腫においても,Ig遺伝子の再構成がサザンプロット法で確認されている。しかしながら,Igが産生されないメカニズムの解明はなされなかった。今回の研究において,こうした瀘胞性リンパ腫のIg非産生の機序を,分子レベルで調べるため,PCR(polymerase chain reaction)法を用いて,Ig重鎖遺伝子のcomplementarity determining region(CDR)3と呼ばれるhypervariableな領域の詳細な解析を行った。 [症例および方法と結果] 症例は54歳,男性。生検による病理診断は,瀘胞性リンパ腫(REAL分類,grade1)。免疫組織学的に,CD10+,CD20+,Ig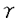 -,Ig -,Ig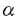 -,Ig -,Ig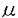 -,Ig -,Ig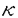 -,Ig -,Ig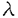 -。この症例は化学療法終了6ケ月後に再発し,その際の病理診断は,瀘胞性リンパ腫(REAL分類grade1)。再発時生検の免疫組織学的検索は,CD10+,CD20+,Ig -。この症例は化学療法終了6ケ月後に再発し,その際の病理診断は,瀘胞性リンパ腫(REAL分類grade1)。再発時生検の免疫組織学的検索は,CD10+,CD20+,Ig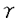 -,Ig -,Ig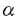 -,Ig -,Ig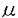 +,Ig +,Ig +,Ig +,Ig -。 -。 まず,この症例の解析に先立ち,ヒト正常扁挑GC細胞の解析をコントロール実験としておこなった。すなわち,凍結標本を10 mに薄切し,位相差顕微鏡を用いて,GCから細胞を採取した。その後,この組織標本を抗IgD抗体による免疫染色,およびヘマトキシリンによる核染色を行い,細胞が正しくGCから採取されているかの確認を行った。各々のGCから得られる細胞の数は約300〜400であった。こうして得られた細胞から,通常のフェノール/クロロホルム抽出によりDNAを得た。 mに薄切し,位相差顕微鏡を用いて,GCから細胞を採取した。その後,この組織標本を抗IgD抗体による免疫染色,およびヘマトキシリンによる核染色を行い,細胞が正しくGCから採取されているかの確認を行った。各々のGCから得られる細胞の数は約300〜400であった。こうして得られた細胞から,通常のフェノール/クロロホルム抽出によりDNAを得た。 つぎに,PCRを行うにあたっての,プライマー設定のストラテジーは以下の通りである。ヒトのVHは200〜300の遺伝子群から,DHは20〜30,JHは6の遺伝子群から各々1つずつの遺伝子が選ばれて,再構成される。そして,再構成後のIg重鎖を構成するVH-DH-JHの長さは,約400bpとなる。また,VHのframework,およびJH内には,各々遺伝子群の間でホモロジーの高い,それぞれhighly conservative reigon,consensus reigonが存在することが知られている。したがって,これら領域内にプライマーを設定することで,VH,DH,JHの3つのsegmentから構成され,クローン間で特異性がきわめて高いと考えられるCDR3増幅することが可能である。そしてその結果,得られるPCR産物のサイズは,80〜140bpの範囲となる(図参照)。 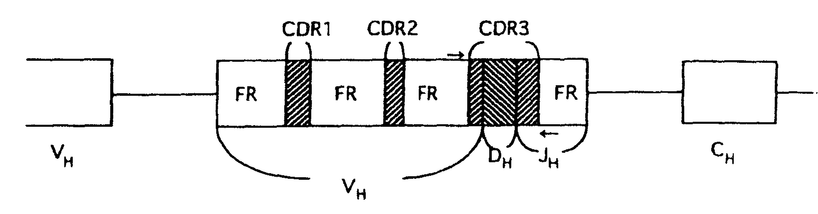 図表 図表 この系を用いて,ヒト正常扁桃GCのB細胞由来のDNAのCDR3をPCR法を用いて増幅した。その結果,多数の瀘胞が存在すると考えられる一つの切片からのDNAでは,期待されるサイズの範囲にスメアーを検出し,各々のGCから採取したDNAでは,8/9例でその範囲に2〜4本のバンドが検出された。この結果は,GCのB細胞はオリゴクローナルという従来の見解と一致している。 以上のGCでの解析を踏まえ,瀘胞性リンパ種において同様の実験を行った。すなわち,Ig陽性,陰性各1例のリンパ腫のスライド標本上の5個の瀘胞からDNAを採取し,PCRを行ったところ,各瀘胞間で同じサイズのバンドが検出された。次に,PCR産物を精製し,TAクローニング法を用いてサブクローニングの後,Ig陰性、陽性の各症例で複数のクローンについてシークエンシングを行った。その結果,Ig陰性瀘胞性リンパ腫においては,CDR3シークエンスは腫傷細胞由来のすべてのクローンで,out-of-frame(3/3)であり,このアレルを用いては,Igが産生されないことが判明した。一方,Ig陽性瀘胞性リンパ腫においても,2/5のクローンでout-of-frameシークエンスが認められた。また,両方の症例において,PCR,およびシークエンス解析から,もう一方のアレルでt(14;18)染色体転座がみられ,Bcl-2タンパクの過剰発現も免疫組織学的検索でみられた。したがって,もう一方のアレルにおいても,Igを産生することはできないことが確認された。このように,Ig陰性瀘胞性リンパ腫においては,DNAレベルで,Igが産生できない遺伝子構造となっていることが判明した。さらに,Ig陽性のびまん性大細胞性リンパ腫2例の,CDR3シークエンスを調べたところ,腫瘍細胞由来のクローンは,すべてin-frameシークエンスであり,クローン間で体細胞変異によるシークエンスの違いは全く見られなかった。そして,Ig陰性瀘胞性リンパ腫症例は再発したが,この時には,immunnophenotypeがIg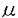 + +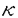 +と変化した。そして,再発時の生検標本においてもCDR3シークエンスの解析を行った。その結果,腫瘍細胞由来のクローンで1塩基の挿入がみられ,in-frameとなり,Ig産生可能なシークエンスとなっていた。 +と変化した。そして,再発時の生検標本においてもCDR3シークエンスの解析を行った。その結果,腫瘍細胞由来のクローンで1塩基の挿入がみられ,in-frameとなり,Ig産生可能なシークエンスとなっていた。 [考察] Igを発現しない瀘胞性リンパ腫はNganら(1989)により報告されたが,彼等の解析でこうしたリンパ腫でもIg重鎖,軽鎖遺伝子ともに再構成がみられ,また,Bcl-2タンパクの過剰発現も確認されている。しかしながら,なぜIg陰性であるのかというメカニズムは解明されなかった。また,彼らのIg陰性の判断は,免疫組織学的方法に基ずいており,この方法は感度の点で問題があり,Igの発現が弱い場合には,陰性と診断される可能性がある。今回の解析は,免疫組織学的に陰性とされた症例を,分子レベルで確認しており,信頼しうるものである。 私は瀘胞からのDNAの採取にあたって,位相差顕微鏡下で濾胞から細胞をクラッチしたが,この方法で得られた結果は満足できるものといえる。なぜなら,1)PCRにより増幅されたバンドは,瀘胞性リンパ腫ではろ胞間で同一サイズであり,一方GCの瀘胞間では違いがみられたこと,2)CDR3シークエンスは,瀘胞性リンパ腫ではGCに比べ,瀘胞間でホモロジーがはるかに高かったことによる。他の方法としてKuppersら(1993)は,マイクロマニュピレーターを用いて,シングル細胞レベルでGCのB細胞の解析を行っている。しかしながら,この方法は1)手技が複雑であり,2)得られた細胞が腫瘍細胞かどうかの判別が行えない,などの難点がある。 今回の我々のシークエンスの解析で,Ig陰性の瀘胞性リンパ腫が,Ig遺伝子において一方のアレルでout-of-frameシークエンス,もう一方のアレルでt(14;18)染色体転座により,Igが産生されないことを明らかにした。しかしながら,この結果は正常のB細胞は,両方のアレルで重鎖遺伝子が非機能的であれば生存できないという報告(北村ら1992)と対照的である。この点に関して,正常T細胞,B細胞ともに産生されない重症免疫不全(severe combined immunodeficiency;SCID)マウスを,bcl-2トランスジェニックマウスに交配したbcl-2/SCIDマウスにおいて,膜型Igを発現しない成熟B細胞が,正常に近いレベルの数で産生されるという報告(Strasserら,1994)があり,Bcl-2蛋白が過剰発現している場合,Igが陰性でも生存可能であることを示唆している。 今回の解析結果から,Igを発現している腫瘍細胞は,発現していない腫瘍細胞に比べ,生存に有利と予想される。しかしながら,Nganらは,初発時にIg陽性で,再発時にIg陰性の症例も報告している。よって,機能的なIg遺伝子の獲得が,瀘胞性リンパ腫のpathogenesisにどのような意味をもつのか,さらなる研究が必要と考えられる。 |