著者はNMR、逆相系HPLC、GC/MS、13C標識体およびエチルオキシム誘導化を用いた、生体内に微量に存在するポリオールの新たな分析法を確立した。本論文は、これらの分析法を用いて哺乳動物であるラットにおける、グリコーゲンから1,5-アンヒドロフルクトース(AF)を介して1,5-アンヒドログルシトール(AG)に至る新奇なグリコーゲン分解経路を発見し、その生成物であるAFおよびAG、およびそれぞれの生成酵素である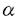 -1,4-glucan lyaseおよびAF reductaseの生化学的な検討を行い論じている。 -1,4-glucan lyaseおよびAF reductaseの生化学的な検討を行い論じている。 第1章では、第3のグリコーゲン分解経路の生成物質であるAGのラットおよびマウスにおける生体内動態、代謝および糖尿病における血中AG減少のメカニズムについて論じている。本論文の以前においては、AGが血中に存在するポリオールの中では、グルコースに次いで高濃度であり、その血中濃度が特異的に減少する事が知られ、糖尿病の指標として注目されていたにも拘わらず、その代謝、生体内動態、生合成経路はもとより、糖尿病における血中濃度減少のメカニズムについては、ほとんど解明されていなかった。著者はGC/MSを用いたAGの高感度分析法を開発し、初めて尿中にAGが存在している事を確認し、糖尿病においてAGの尿中排泄が亢進しているために血中AG濃度減少が引き起こされる事を解明した。また、放射活性標識AGを用いたラットおよびマウスにおける分布および代謝実験により、体外から投与されたAGは速やかに体内各組織に広く分布し、かつ体内各組織に効率よく保持され、その時に呼気中に二酸化炭素として排泄された放射活性は僅かで、体内各組織に分布している放射活性および尿中に存在していた放射活性の大半は未変化体であった事から、AGが生体内で代謝を受けにくい物質である事を明らかにした。これらの結果は現在糖尿病の指標として治療に用いられているAGの有用性の科学的根拠の一つとなっている。 第2章では、第3のグリコーゲン分解経路の中間生成物質であるAFのNMR、HPLC、GC/MSを用いた化学的性質および合成法の検討、生体内AFの分析法の確立およびラット肝臓中AFの検出について論じている。最近になり、中村らによりバクテリアに存在する酵素によりAGの2位の水酸基が酸化されてAFが生成するという報告があり、一方、SwedenのYuらにより海藻中に存在する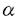 -1,4-glucan lyaseによりデンプンおよびグリコーゲン等の2-1,4-glucan類のdegradationによりAFが生成するという報告がされている。著者は、これらの実験事実から、哺乳動物におけるAGの生合成および代謝という観点からAFに注目した。 -1,4-glucan lyaseによりデンプンおよびグリコーゲン等の2-1,4-glucan類のdegradationによりAFが生成するという報告がされている。著者は、これらの実験事実から、哺乳動物におけるAGの生合成および代謝という観点からAFに注目した。 しかし、この時点では哺乳動物におけるAFの生体内動態、代謝および生合成経路等の生化学的な性質は勿論のこと、哺乳動物における存在自体についても全く明らかになっていなかった。著者はAFの生化学研究を始める第1段階としてAFの化学的性質を明らかにし、それを基に生体試料中AFの高感度分析法の確立を行った。AFの化学的性質を明らかにする為に、著者は炭素骨格中の炭素を全て13C核に置換した[13C6]AFと13C-NMRを組み合わせた分析法によりAFの化学的性質および酵素を用いたAF合成反応の検討を行った。近年13C-NMRは天然物質の分析に広く用いられているが、自然界における13C核の存在比が12C核に対して1%程度と低値なために13C-NMR測定には1H-NMRと比較して大量の測定試料が必要であり、かつ2次元13C-NMR測定は感度の点で困難であった。そこで著者は試料に全13C標識体を用いた13C-NMR分析を行ったところ、短時間で高感度に2次元13C-NMRが測定できた。そこで著者は、リン酸緩衝液中、カタラーゼ存在下で、Polyporus obstus由来の粗glucose 2-oxidaseにより[13C6]AGの2位の水酸基の酸化反応を行い、経時的に反応液の13C-NMR測定を行ったところ、酵素および緩衝液からの妨害を受ける事なく、AGからAFへの酸化反応を良好に観測する事ができている。その結果、生成したAFは水溶液中では2位のカルボニル基が水和したgem-dio構造をとっている事を明らかにした。これら全13標識体と13C-NMRを用いた分析法は非破壊的に反応溶液の様な混合物の状態でもreal timeに反応を追跡できる点で優れたものであり、汎用的に応用する事ができる点で評価に値する。さらに著者はAFの合成に用いた粗glucose 2-oxidaseには不純物としてhexose dehydrataseが含まれており、粗glucose 2-oxidaseにEDTAを添加する事によりdehydrataseの影響を取り除くことが可能であることも13C-NMRを用いた分析により確認し言及している。AFはその構造上の特性から水和および互変異性化が生じるために、これまでにAGの分析に用いてきた順相およびイオン交換等のHPLCカラムによる生成は困難であった。そこで著者はエチルオキシム誘導化試薬のO-ethylhydroxylamineをAFに作用させて、AFをエチルオキシム化する事によりAFを化学的に安定化する事ができた。さらにエチルオキシム基の疎水性により、AFエチルオキシムは逆相系HPLCカラムによる効果的な濃縮精製が可能である事を見いだした。またHPLC精製の後にトリメチルシリル化しGC/MS分析する事により、生体内AFの高感度分析法を確立した。著者は、この分析法を用いて、ラット肝臓中にAFが存在している事を初めて確認した。 第3章において著者は第2章で確立した分析法をさらに発展させ、内部標準に[13C6]AFを用いた微量定量法を確立し、ラットにおけるAFの体内分布を検討したところ、AFは肝臓に最も多く存在しており、同時に測定したグリコーゲンおよびAGの体内分布と比較すると、AFの体内分布がグリコーゲンの体内分布と類似しており、この事からAFとグリコーゲンとの密接な関係が示唆された。またAGは全身に亘って広く分布しており、AFの体内分布とは明らかに異なっていた。著者は、これらの結果から、肝臓がAFの合成および代謝の中心臓器であり、グリコーゲンとの密接な関係が示唆された事に着目し、ラット肝lysateにグリコーゲン等の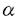 -1,4-glucan類を添加し37℃でインキュベートを行った結果、反応液中にAFの生成が認められた。しかし、基質にglucose、AG、glucose 1-phosphateを用いた場合にはAFの生成が認められなかった。これらの結果により、ラット肝臓中にグリコーゲン等のa-1,4-glucan類を直接degradationしてAFを生成する -1,4-glucan類を添加し37℃でインキュベートを行った結果、反応液中にAFの生成が認められた。しかし、基質にglucose、AG、glucose 1-phosphateを用いた場合にはAFの生成が認められなかった。これらの結果により、ラット肝臓中にグリコーゲン等のa-1,4-glucan類を直接degradationしてAFを生成する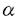 -1,4-glucan lyase活性が哺乳動物に存在する事を初めて明らかにした。この事は哺乳動物にglycogen phosphorylaseおよびexo-glycosidase以外の第3のグリコーゲン分解系が存在する事を初めて見いだした点で興味深い。これまでに、鈴木らによりヒト白血病由来K-562細胞においてAFからAGへの還元が効率良く行われる事が報告されている。そこで著者はラット肝臓のcytosol画分を、AFと補酵素としてNADPHもしくはNADH存在下でインキュベートしたところ反応液中にAGの生成を確認した。また補酵素非存在下ではAG生成が認められなかった。さらにNADPもしくはNAD存在下での逆反応は認められない事を確認している。この章における一連のAFに関する生化学研究により著者は、AFが哺乳動物に存在し、かつAFがグリコーゲンの加リン酸分解および加水分解以外の第3のグリコーゲン分解経路で生成し、これまでに不明であったAGの生合成経路がグリコーゲン等の -1,4-glucan lyase活性が哺乳動物に存在する事を初めて明らかにした。この事は哺乳動物にglycogen phosphorylaseおよびexo-glycosidase以外の第3のグリコーゲン分解系が存在する事を初めて見いだした点で興味深い。これまでに、鈴木らによりヒト白血病由来K-562細胞においてAFからAGへの還元が効率良く行われる事が報告されている。そこで著者はラット肝臓のcytosol画分を、AFと補酵素としてNADPHもしくはNADH存在下でインキュベートしたところ反応液中にAGの生成を確認した。また補酵素非存在下ではAG生成が認められなかった。さらにNADPもしくはNAD存在下での逆反応は認められない事を確認している。この章における一連のAFに関する生化学研究により著者は、AFが哺乳動物に存在し、かつAFがグリコーゲンの加リン酸分解および加水分解以外の第3のグリコーゲン分解経路で生成し、これまでに不明であったAGの生合成経路がグリコーゲン等の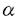 -1,4-glucanからAFを経由して生合成されている事を初めて明らかにした事は評価に値する。 -1,4-glucanからAFを経由して生合成されている事を初めて明らかにした事は評価に値する。 第4章において、著者は第3章で発見したラット肝臓中に存在する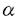 -1,4-glucan lyaseの生化学的検討を行っている。最近になり海藻に存在する -1,4-glucan lyaseの生化学的検討を行っている。最近になり海藻に存在する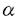 -1,4-glucan lyaseがYuらにより純粋に精製されて分子量が約100kDaであり -1,4-glucan lyaseがYuらにより純粋に精製されて分子量が約100kDaであり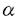 -1,4-glucanの糖鎖の非還元末端を直接lyase反応により切断しAFを生成する事が報告されている。また酵素活性が光により影響される事から、海藻中のデンプン生成および分解系にAFおよび -1,4-glucanの糖鎖の非還元末端を直接lyase反応により切断しAFを生成する事が報告されている。また酵素活性が光により影響される事から、海藻中のデンプン生成および分解系にAFおよび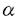 -1,4-glucan lyaseが関与している可能性について論じている。これらの結果は哺乳動物に存在する -1,4-glucan lyaseが関与している可能性について論じている。これらの結果は哺乳動物に存在する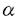 -1,4-glucan lyaseおよびAFの糖代謝上の意義および生理的な意義を考える上でも興味深いものであった。そこで著者はラット肝臓中の -1,4-glucan lyaseおよびAFの糖代謝上の意義および生理的な意義を考える上でも興味深いものであった。そこで著者はラット肝臓中の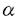 -1,4-glucan lyase活性について生化学的検討を行った結果、ラット肝臓細胞分画において -1,4-glucan lyase活性について生化学的検討を行った結果、ラット肝臓細胞分画において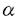 -1,4-glucan lyase活性は主として肝細胞の可溶性画分に存在し、20mMのリン酸緩衝液(pH7.6)で平衡化した陰イオン交換樹脂に吸着し0.3M NaClで溶出される事を見いだした。またアミロースゲルにて精製した後、ゲルろ過カラムによる分析を行った結果、 -1,4-glucan lyase活性は主として肝細胞の可溶性画分に存在し、20mMのリン酸緩衝液(pH7.6)で平衡化した陰イオン交換樹脂に吸着し0.3M NaClで溶出される事を見いだした。またアミロースゲルにて精製した後、ゲルろ過カラムによる分析を行った結果、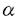 -1,4-glucan lyaseの分子量が約100kDaである事を確認した。また著者はDE-52カラムで精製した -1,4-glucan lyaseの分子量が約100kDaである事を確認した。また著者はDE-52カラムで精製した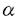 -1,4-glucan lyase活性は高濃度のglucose(100mM)で50%程度に活性が阻害された以外には、glucose 1-phosphate、glucose 6-phosphateによる影響を受けない事を確認した。これらの事から著者は、 -1,4-glucan lyase活性は高濃度のglucose(100mM)で50%程度に活性が阻害された以外には、glucose 1-phosphate、glucose 6-phosphateによる影響を受けない事を確認した。これらの事から著者は、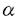 -1,4-glucan lyase活性がglycogen phosphorylaseおよびexo-glycosidaseの副反応により生じているのではない、と論じている。また -1,4-glucan lyase活性がglycogen phosphorylaseおよびexo-glycosidaseの副反応により生じているのではない、と論じている。また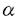 -1,4-glucan lyase活性がglycosidaseの阻害剤と知られている1-deoxynojirimycinにより阻害された事から -1,4-glucan lyase活性がglycosidaseの阻害剤と知られている1-deoxynojirimycinにより阻害された事から -1,4-glucan lyaseがglycosidaseと酵素群を形成している可能性について論述している。 -1,4-glucan lyaseがglycosidaseと酵素群を形成している可能性について論述している。 以上、本論文の内容である。一方、グリコーゲンの代謝については古くから研究が行われているが、著者が新たに、グリコーゲン鎖を脱離分解してAFを生成する代謝経路が哺乳動物に存在する事を発見した事は評価に値する。さらに本研究で確立された、13C-NMRと13C標識体を用いた分析法、エチルオキシム誘導化-逆相系HPLCカラム-GC/MSを用いた高感度分析法は、AFおよびAGの生化学研究のみならず、汎用的に用いる事が可能であり、生化学の分野に新たな手法を提供した点についても評価できる。また本論文に関連して公表した各論文に対する本著者の寄与は極めて大きいことを認める。 よって本論文は博士(学術)の学位請求論文として合格と認められる。 |