自食作用は自己の構成成分を非選択的に液胞/リソソームに送り込み分解する現象である。これは、真核細胞に普遍的な現象であり、新たな環境への適応に関与すると考えられている。当研究室で、酵母においても栄養飢餓によって自食作用が誘導されることが見出された。その進行は光学顕微鏡下に容易に観察でき、これに基いて自食作用変異(apg)株群が単離され、自食作用の誘導には少なくとも14の遺伝子が関与することが示された。apg変異株群はいずれも自食作用という極めて限定された表現型を示すことから近傍で機能することが予想される。また最近APG遺伝子がアミノペプチダーゼlの細胞質から液胞への輸送にも必要であることが明らかになった。栄養飢餓の感知、膜構造体の構築から分解に至る複雑な現象について理解する上でapg変異株の性質、その遺伝子や遺伝子産物についての解析は不可欠である。本研究において自食作用の分子機構を明らかにすることを目的として、APG遺伝子間で相互作用するものを検索し、その中の一つAPG13の解析を行った。 APG1産物はSer/Thrプロテインキナーゼをコードしており、そのキナーゼ活性が自食作用の誘導に必須であることが示されていた。Apg1pキナーゼの上流または下流で働く因子がAPG遺伝子群中に存在する可能性が考えられる。そこで、APG1遺伝子を全てのapg変異株群に導入し、過剰発現させたところ、それらの中でapg13-1変異株の自食作用能が回復した(Fig.1)。このことは、Apg1pとApg13pが近傍で機能している可能性を示している。そこで、APG13の構造解析を開始した。 飢餓条件下ではapg13-1変異株の生存率が低下する。apg13-1変異株に酵母のゲノムライブラリーを導入し、飢餓条件下で生存可能となったクローンをスクリーニングした。さらにその中から自食作用能を回復した株を光学顕微鏡観察によって選択した結果、1つのクローンが得られた。回収された遺伝子断片中の最小相補領域の塩基配列を決定したところ約2.2kbのORFを含んでおり、遺伝学的解析によってこれがAPG13自身であることがわかった。Apg13pはグルタミンに富んだ領域と、酸性アミノ酸のクラスターを二カ所有する推定分子量約83kDの738アミノ酸からなる新規の親水性蛋白質であった。APG13の遺伝子破壊株は、栄養増殖が可能で、apg13-1と同様に飢餓条件下で生存率が低下し、自食作用不能であった。 栄養飢餓による転写レベルでの影響をNorthern blot解析により検討した。その結果、富栄養条件下でもAPG13の転写は起きており細胞を窒素源飢餓培地に移した後もそのレベルに変化はなかった。次に、APG13遺伝子産物、Apg13pの解析を進めるためにApg13pとGSTとの融合蛋白質を大腸菌で発現させ精製した後、これを抗原としてApg13pに対する特異的抗体を作成した。この抗体を用いて栄養増殖細胞中のimmunoblottingを行ったところ、予想される分子量約82kDから100kDにかけて5-6本のバンドがラダー状に検出された。これらのバンドはAPG13遺伝子破壊株では見られず、APG13を多コピーベクターで発現させると増加することよりAPG13の遺伝子産物であり、Apg13pは幾つかの異なった様式で存在する蛋白質であると考えられる。 一方、APG13をreticulocyte lysateのin vitro系を用いて翻訳させたところ、immuno-blottingで見られた様なラダー状の高分子量のバンドは検出されなかったことから、Apg13pは翻訳後に何らかの修飾を受けることが示された。さらに興味深いことに、Apg13pの修飾は栄養条件によって急激に変化することが明らかになった(Fig.2)。細胞を飢餓培地に移すと、栄養培地中でみられた修飾型が時間経過にともに減少し、1時間後には約80-kDa以上の修飾型のApg13pは殆ど検出されなかった。この飢餓培地で1時間培養した細胞に新たに栄養源を添加すると再び高分子量の修飾型が現われた。 そこで、Apg13pがどのような修飾を受けているかについて検討を行った。まず、ユビキチン化の可能性について検討した。プロテアソームのサブユニットの一つをコードしているPRE1の変異株を用いてApg13pの変化を調べたが、飢餓条件下での修飾型Apg13pの減少も野生株と同様に観察されたことから、Apg13pがユビキチン化されプロテアソーム系により修飾型が分解されることはないと考えられる。修飾型の再出現がツニカマイシン処理によって阻害されなかったことからN-結合型の糖鎖付加によるものでもないと結論した。次に、リン酸化について調べた。35Sで標識した細胞から、免疫沈降したApg13pをアルカリホスファターゼ処理すると修飾型が減少し、さらに、32P正リン酸を含む培地中で培養したところApg13pに32Pが取り込まれたことから、Apg13pはリン酸化されることが明らかになった(Fig.3)。またパルスーチェイス実験の結果、飢餓培地中でのチェイスでリン酸化型Apg13pが減少した。一方、栄養培地ではリン酸化型は安定に存在することがわかった。以上の結果からApg13pはリン酸化蛋白質であること、そのリン酸化の状態が細胞外の栄養条件に呼応して急激に変化することが明らかになった。いずれのapg変異株中でも野生株と同様、栄養条件に呼応してApg13pがリン酸化、脱リン酸化されたことから、他のAPG遺伝子はApg13pのリン酸化の制御に関わっていないと結論した。また遺伝学的相互作用があったApg1pプロテインキナーゼの遺伝子破壊株中でもApg13pはリン酸化されることから、Apg1p以外のプロテインキナーゼの関与が考えられる。また、飢餓条件でApg13pが脱リン酸化されることからホスファターゼの存在が考えられ、動物細胞におけるホスファターゼ阻害剤による自食作用の阻害効果との関係も興味深い。栄養条件下ではAPG13はアミノペプチダーゼlの輸送に必要であり、飢餓条件下では自食作用に必要である。Apg13pのリン酸化状態の変化はこれら二つの経路の切り換えに関わっている可能性も考えられる。 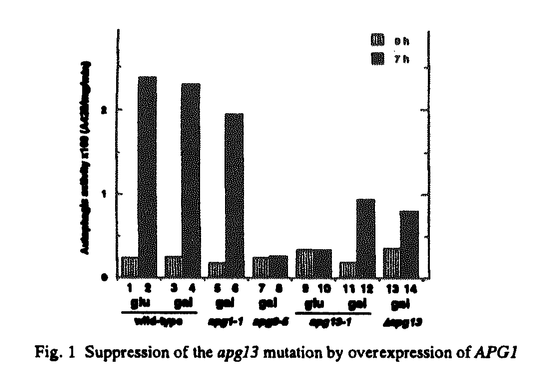 Fig.1 Suppression of the apg13 mutation by overexpression of APG1 Fig.1 Suppression of the apg13 mutation by overexpression of APG1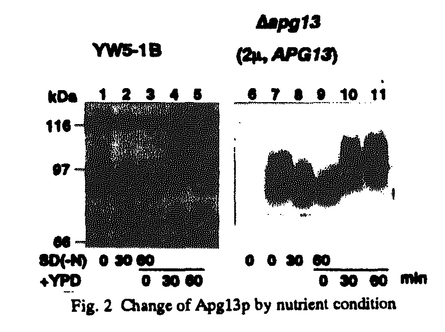 Fig.2 Change of Apg13p by nutrient condition Fig.2 Change of Apg13p by nutrient condition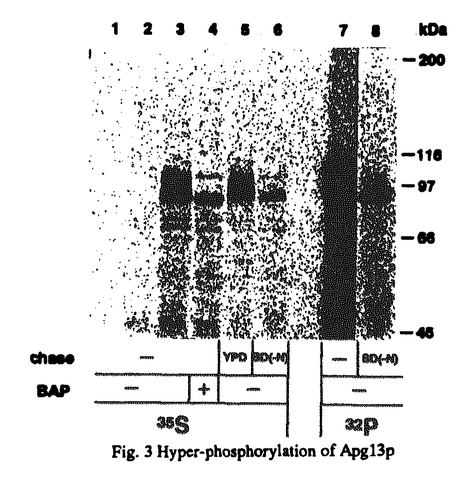 Fig.3 Hyper-phosphorylation of Apg13p Fig.3 Hyper-phosphorylation of Apg13p |