本論文では、シャペロニンGroELが認識して結合するタンパク質の構造の特徴について述べられている。論文提出者は、牛の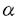 -ラクトアルブミンをモデル標的タンパク質として用いてGroELが認識し結合するタンパク質の構造の特徴を調べた。 -ラクトアルブミンをモデル標的タンパク質として用いてGroELが認識し結合するタンパク質の構造の特徴を調べた。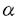 -ラクトアルブミンはカルシウム・イオンを一個結合しているタンパク質で、4つのジスルフィド結合を持ち、123個のアミノ酸から成り、分子量は14200である。論文提出者は、 -ラクトアルブミンはカルシウム・イオンを一個結合しているタンパク質で、4つのジスルフィド結合を持ち、123個のアミノ酸から成り、分子量は14200である。論文提出者は、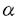 -ラクトアルブミンの中にある4つのジスルフィド結合をすべて還元切断した還元- -ラクトアルブミンの中にある4つのジスルフィド結合をすべて還元切断した還元-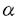 -ラクトアルブミン(RLA)はGroELに強く結合し、これらのタンパク質の複合体が分子ふるいクロマトグラフィーで分離できることをまず示した。 -ラクトアルブミン(RLA)はGroELに強く結合し、これらのタンパク質の複合体が分子ふるいクロマトグラフィーで分離できることをまず示した。 論文提出者は次に、RLAを用いて、GroELによって認識されるタンパク質の構造の特徴を詳しく調べている。4つのジスルフィド結合が切断されているために、RLAは、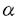 -ラクトアルブミンの天然構造やモルテン・グロビュール構造よりも、より崩れた構造をとっている。論文提出者は、RLAの構造はどのくらい崩れているのかを見積もるために、RLAのCDスペクトルをChen等の方法を用いて解析した。その結果、RLAの中に残っている二次構造の量は、 -ラクトアルブミンの天然構造やモルテン・グロビュール構造よりも、より崩れた構造をとっている。論文提出者は、RLAの構造はどのくらい崩れているのかを見積もるために、RLAのCDスペクトルをChen等の方法を用いて解析した。その結果、RLAの中に残っている二次構造の量は、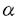 ヘリックスが24%、 ヘリックスが24%、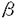 シートが14%であった。一方、天然構造の シートが14%であった。一方、天然構造の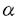 -ラクトアルブミンは、 -ラクトアルブミンは、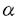 ヘリックスを37%、 ヘリックスを37%、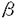 シートを11%含んでいるという結果を得た。このようにRLAは、天然構造に比べて構造が崩れているとはいえ、まだかなりの量の二次構造を持っている。そこで、RLAの二次構造が、RLAとGroELの結合にどのようにかかわっているのかを調べるために、論文提出者は水素交換実験を行った。水素交換の実験では、まずRLAの主鎖のペプチド結合部分にあるアミド・プロトンを、すべて、トリチウムに置き換える。そして、RLAの中のトリチウムが溶媒の水分子の中にあるプロトンと入れ換わっていく時間経過を測定した。この実験の結果、RLAのアミド・プロトンの水素交換の挙動は、RLAがGroELに結合している時でも、結合していない時と同じであることがわかった。アミド・プロトンはタンパク質の二次構造の中で水素結合を形成しているので、アミド・プロトンが溶媒の水分子中のプロトンと入れ換わる速さは、二次構造の中でどのくらい強い水素結合が形成されているか、つまり二次構造の安定性、に非常に敏感に影響を受ける。したがって、もしRLAの中の二次構造がGroELと相互作用するならば、その相互作用によりRLAの二次構造の安定性が変り、RLAのアミド・プロトンの水素交換の速さはRLAがGroELに結合している時と結合していない時では大きく異なるはずである。ところが実験の結果は、RLAのアミド・プロトンの水素交換の挙動はRLAがGroELに結合しているいないに関わらず同じであった。従って、論文提出者の水素交換の実験の結果は、RLAの中にある二次構造は、RLAとGroELとの結合にかかわってはいないであろうことを示している。 シートを11%含んでいるという結果を得た。このようにRLAは、天然構造に比べて構造が崩れているとはいえ、まだかなりの量の二次構造を持っている。そこで、RLAの二次構造が、RLAとGroELの結合にどのようにかかわっているのかを調べるために、論文提出者は水素交換実験を行った。水素交換の実験では、まずRLAの主鎖のペプチド結合部分にあるアミド・プロトンを、すべて、トリチウムに置き換える。そして、RLAの中のトリチウムが溶媒の水分子の中にあるプロトンと入れ換わっていく時間経過を測定した。この実験の結果、RLAのアミド・プロトンの水素交換の挙動は、RLAがGroELに結合している時でも、結合していない時と同じであることがわかった。アミド・プロトンはタンパク質の二次構造の中で水素結合を形成しているので、アミド・プロトンが溶媒の水分子中のプロトンと入れ換わる速さは、二次構造の中でどのくらい強い水素結合が形成されているか、つまり二次構造の安定性、に非常に敏感に影響を受ける。したがって、もしRLAの中の二次構造がGroELと相互作用するならば、その相互作用によりRLAの二次構造の安定性が変り、RLAのアミド・プロトンの水素交換の速さはRLAがGroELに結合している時と結合していない時では大きく異なるはずである。ところが実験の結果は、RLAのアミド・プロトンの水素交換の挙動はRLAがGroELに結合しているいないに関わらず同じであった。従って、論文提出者の水素交換の実験の結果は、RLAの中にある二次構造は、RLAとGroELとの結合にかかわってはいないであろうことを示している。 論文提出者は次に、GroELとRLAが結合する際の熱の出入りを、等温滴定型熱量計で調べ、RLAとGroELの結合は、低温において、吸熱反応であることを示した。この結果は、RLAとGroELの結合の際のエントロピーの増加が、これらのタンパク質の結合を促していることを意味し、疎水性相互作用がRLAとGroELの結合にとって重要であることを示している。 以上に述べたように、本論文は還元-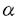 -ラクトアルブミン(RLA)をモデル標的タンパク質として用いて、シャペロニンGroELが認識して結合するタンパク質の構造の特徴について詳細に調べたものである。GroELの分子量は -ラクトアルブミン(RLA)をモデル標的タンパク質として用いて、シャペロニンGroELが認識して結合するタンパク質の構造の特徴について詳細に調べたものである。GroELの分子量は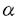 -ラクトアルブミンの分子量の約50倍である。従って、分光学的な方法でGroELに結合したタンパク質の構造の詳細を調べるのは、GroELのシグナルが大きいために難しい。論文提出者は、水素交換という手法を用いて、RLAがGroELに結合したときのRLAの構造について調べた。そして、フリーのRLAとGroELに結合したRLAの水素交換の挙動を比較し、RLAの二次構造はGroELによって認識されないことを明らかにしたものである。この水素交換実験の結果を含めた本論文中に述べられている結果は、GroELと標的タンパク質の結合のメカニズムに対して新しい知見を与えるものである。よって、博士(理学)の学位を授与できると認める。 -ラクトアルブミンの分子量の約50倍である。従って、分光学的な方法でGroELに結合したタンパク質の構造の詳細を調べるのは、GroELのシグナルが大きいために難しい。論文提出者は、水素交換という手法を用いて、RLAがGroELに結合したときのRLAの構造について調べた。そして、フリーのRLAとGroELに結合したRLAの水素交換の挙動を比較し、RLAの二次構造はGroELによって認識されないことを明らかにしたものである。この水素交換実験の結果を含めた本論文中に述べられている結果は、GroELと標的タンパク質の結合のメカニズムに対して新しい知見を与えるものである。よって、博士(理学)の学位を授与できると認める。 なお以上の研究は、勝又来未子氏、二階堂清和氏、伊倉貞吉氏、桑島邦博助教授との共同研究であるが、本論文で述べられているすべての結果は、論文提出者が主体となって実験と分析を行い得られたものであることを確認した。 |