細いフィラメントの研究はアクチン、トロポミオシンとトロポニンからの再構成した細いフィラメントについて行われる研究が多く、天然の細いフィラメントの研究は極めて少ない。天然の細いフィラメントのタンパク質構成と立体構造は分かっていなかった。 天然アクトミオシンは、再構成した系よりも、カルシウムによって良く制御されることなどが知られていたが、なぜこのような機能的な違いが生じるかも、構造がどの様に異なるのかも明らかになっていない。アクチンフィラメントとミオシンだけでも滑り運動は起こるが、カルシウム制御は効かない。トロポミオシンとトロポニンを加えた後、初めてカルシウム感受性を持つ。しかし、生体内では、天然の細いフィラメントはおそらくアクチン、トロポミオシンとトロポニン以外のタンパク質も含まれている。そこで再構成系フィラメントと天然のフィラメントは立体構造が異なっている可能性が高い。 分子量800,000の巨大分子ネブリンの構造と機能はまだ分かっていない。分子量が大きく、簡単に生体内蛋白分解酵素に分解されるため、生理的状態での単離もできていない。天然の細いフィラメントには、ネブリンが巻いていると推定されてきた。免疫電子顕微鏡の研究によって、ネブリンフィラメントは細いフィラメントが存在している区域に局在している。NMR法による研究結果によると、ネブリンフィラメントは一本の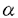 -ヘリックスになっていると推測され、機能としては、生体内の細いフィラメントの長さを制御していると考えられている。ファロイジンを加えるとネブリンが細いフィラメントから解離することが知られている。もし、分離した天然の細いフィラメントの中にネブリンフィラメントが含まれていて、しかも、細いフィラメントの二重螺旋に沿っていたら、天然の細いフィラメントを三次元再構成すれば、ネブリンフィラメントを観察できると考えた。 -ヘリックスになっていると推測され、機能としては、生体内の細いフィラメントの長さを制御していると考えられている。ファロイジンを加えるとネブリンが細いフィラメントから解離することが知られている。もし、分離した天然の細いフィラメントの中にネブリンフィラメントが含まれていて、しかも、細いフィラメントの二重螺旋に沿っていたら、天然の細いフィラメントを三次元再構成すれば、ネブリンフィラメントを観察できると考えた。 1970年、P.B.Moore,H.E.HuxleyとD.J.DeRosierは筋原繊維の細いフィラメントを電子顕微鏡で撮影し、三次元再構成を行った、1980年、J.SeymourとE.J.O’Brienはホモジェネートの細いフィラメントについても三次元再構成を行った。しかし、彼らは本研究によって見つけた二重螺旋に沿った成分は観察できなかった。 私は天然の細いフィラメントの蛋白質構成と立体構造を明らかにするために、天然アクトミオシンから、天然の細いフィラメントの分離を行った。 より天然に近いアクトミオシンを得る為に、最初短時間カルシウム存在下で処理し、素早くカルシウムを除いて天然アクトミオシンを抽出したところ、切断されていないネブリンとコネクチンを含む天然アクトミオシンを得た。これは完全なネブリンとコネクチンを含む天然アクトミオシンの初めての抽出法の開発である。これまで天然アクトミオシンから、天然の細いフィラメントを分離することは困難であった。天然アクトミオシンを弛緩状態とし、高イオン強度で太いフィラメントを溶かし、重水/軽水密度勾配超遠心法で細いフィラメントの分離精製に成功した。ネブリンと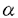 -アクチンニンのSDS電気泳動パターンのバンドの濃さは精製の過程でほとんど変わらないことが分かった。これはネブリンがアクチンと結合しているという初めて直接的な証拠である。分離した細いフィラメントを負染色して電子顕微鏡で撮影した。アクチンとトロポミオシンから再構成したフィラメントも同じ条件で撮影し、比較した結果、分離した天然の細いフィラメントは再構成細いフィラメントより太く、二重螺旋成分がはっきりするが、アクチンのモノマーはよく観察されないという違いがあることが分かった。 -アクチンニンのSDS電気泳動パターンのバンドの濃さは精製の過程でほとんど変わらないことが分かった。これはネブリンがアクチンと結合しているという初めて直接的な証拠である。分離した細いフィラメントを負染色して電子顕微鏡で撮影した。アクチンとトロポミオシンから再構成したフィラメントも同じ条件で撮影し、比較した結果、分離した天然の細いフィラメントは再構成細いフィラメントより太く、二重螺旋成分がはっきりするが、アクチンのモノマーはよく観察されないという違いがあることが分かった。 細いフィラメントの生きたままの微細構造を明らかにすることを目的として氷包埋電子顕微鏡法を適用した。氷包埋電子顕微鏡法で得られた電子顕微鏡像をディジタル化した後、画像処理を行った。フーリエ変換した結果、細いフィラメントの二重螺旋の層線がよく見えた。層線を切り出して三次元再構成をした。本研究ではクライオ電子顕微鏡法を用いたので、細いフィラメントのより生理的状態の構造が分かる。 本研究での分解能は少なくとも2.7nmある。原子座標レベルで、天然の細いフィラメントの三次元構造を明らかにするために、三次元像にアクチンの原子モデルをフィットした。三次元再構成像の対称軸を中心とし、アクチンの原子モデルを回転し、縦方向にもシフトする。各位置でのすべての原子の原子座標のところの三次元像の密度を加算してフィットの良さを示す点数にした。三次元再構成像にはZ線に対しての向きが分からないから、逆方向の三次元像にもフィットして、向きと位置を決めた。 電子顕微鏡写真の直接倍率を確認するために、装置の倍率の付近の仮定倍率の三次元像を作って、それらの像にアクチンの原子モデルをフィットした。その結果、実際に倍率は装置の倍率と一致していた。 天然の細いフィラメントの中にネブリンフィラメントの局在部位を決定するために、アクチン、トロポミオシンとトロポニンから再構成した細いフィラメントの三次元像の構造の違いのt検定を行った。その結果、アクチンフィラメントの二重螺旋の間に不連続的な有意の差を示す傾域が観察された。その位置は天然の細いフィラメントと再構成細いフィラメントの三次元再構成像を見比べてみても、直感的に分かる。再構成の細いフィラメントの三次元像では、その部分がかなり凹んでいることがよくわかる。その位置とファロイジンの結合部位はほとんど一致していた。この結合部位なら、ファロイジンを加えるとネブリンが細いフィラメントから解離することを説明することができる。 更に、アクチンとネブリンの静電的な相互作用を計算し、螺旋対称性に従ってネブリンとアクチンの相対位置を決めた。ネブリンのアミノ酸配列の中よく保存されているSDxxYKはtマップの中、有意差が一番大きな所と一致している。これもtマップの中、どうして連続的に差が見えないということの説明のヒントになる。つまり、ネブリンフィラメントが恐らく全長に渡ってアクチンと相互作用しているが、強く結合する場所と相対的に弱く結合する場所がある。弱く結合しているところは揺れていて、画像処理の平均化によって、信号が弱くなって、有意差が観察できなくなる。それに対して、強く結合しているところが平均の後でも観察される。だから、SDxxYKモチーフがアクチンと一番強く結合していると考えられる。 一方、天然の細いフィラメントの中にトロポミオシンの局在部位を決定するために、AMPPNPをヌクレオチドとして含むアクチンから再構成したアクチンフィラメントの三次元像との差のtマップも求めた。その結果、アクチンのサブドメイン1とサブドメイン2の所に大きな差が見られた。これらの像は弛緩中の筋肉なので、他の研究グループの主張しているトロポミオシンの位置と一致する。その上、tの値が小さくなるとき、危険率が20%ぐらいになるとき、ネブリンに相当するtマップも見られた。位置は天然の細いフィラメントと再構成細いフィラメントの差のtマップの結果と一致する。 トロポミオシンが細いフィラメントの中で、ジグザグな構造を取っていることがこの研究で初めて観察された。アミノ酸配列分析によると、トロポミオシンには5.9nmの周期性がある。しかし、アクチンの螺旋対称性からみると、アクチンの周期は5.5nmである。つまり、トロポミオシンはアクチンの周期より0.4nmが長いということになる。本研究の結果では、トロポミオシンがジグザグしているため、トロポミオシンの周期とアクチン表面の周期がぴったり一致する。だから、天然の細いフィラメントの中で、トロポミオシンは結晶中の構造と違って、ジグザグな構造をしていると考えられる。 更に、トロポミオシンの電荷分布とアクチン表面の電荷分布を考えて、トロポミオシンとアクチンの相対位置を決めた。トロポミオシンの負電荷の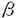 サイトはアクチン側のLys61,Arg62と相互作用する。トロポミオシンの正電荷がミオシンと結合するアクチン側の負電荷残基Asp24,Asp25とGlu334をカバーしていることも分かった。そしてトロポミオシンの負電荷の サイトはアクチン側のLys61,Arg62と相互作用する。トロポミオシンの正電荷がミオシンと結合するアクチン側の負電荷残基Asp24,Asp25とGlu334をカバーしていることも分かった。そしてトロポミオシンの負電荷の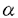 -サイトはアクチン側のArg147,Lys328と相互作用する。トロポミオシンのもう一つ正電荷サイトがアクチン側のAsp292,Asp288と相互作用している。 -サイトはアクチン側のArg147,Lys328と相互作用する。トロポミオシンのもう一つ正電荷サイトがアクチン側のAsp292,Asp288と相互作用している。 これまで天然アクトミオシンは、再構成した系よりも、カルシウムによって良く制御されることなどが知られていた。本研究はアクチン、トロポミオシンとトロポニン以外の構成タンパクに注目した天然の細いフィラメントの構造の初めての研究になった。 本研究により開発された完全なネブリンとコネクチンを含む天然アクトミオシンの抽出法および完全なネブリンを含む天然の細いフィラメントの分離法は初めてである。これらの方法は、これから筋肉の収縮機構、特に生体内に近い状態に関する研究に役に立つと考えている。この研究によって、天然の細いフィラメントの中、ネブリンフィラメントが初めて観察された。そして、天然の細いフィラメントとアクチンフィラメントの比較結果によって、屈曲したトロポミオシンのモデルを提唱した。 |