筆者は、博士課程において、金属酸化剤および光電子移動による一電子酸化反応を用いる反応活性種の生成、さらに、それを用いる炭素-炭素結合生成反応の開発について検討した。 1.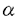 -スタンニルスルフィドと共役エノン類との光電子移動反応 -スタンニルスルフィドと共役エノン類との光電子移動反応 これまで、多くの光電子移動反応が知られているが、一般に選択性あるいは収率も悪く、有機合成への利用は極めて限られている。筆者はスズ-炭素結合の結合エネルギーが小さなことに着目し、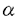 -スタンニルスルフィドを光-電子酸化すれば生じるカチオンラジカルから -スタンニルスルフィドを光-電子酸化すれば生じるカチオンラジカルから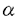 -アルキルチオラジカルが生成し、電子不足オレフィンに付加反応するのではないかと考え検討を行った。 -アルキルチオラジカルが生成し、電子不足オレフィンに付加反応するのではないかと考え検討を行った。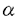 -スタンニルスルフィド1と2-シクロヘキセノンをメタノール中で光照射すると、スルフィド1から励起されたシクロヘキセノンに一電子移動が起こり、スルフィド1のカチオンラジカルとシクロヘキセノンのアニオンラジカルとのラジカルイオン対が生成する。さらにこのカチオンラジカルにメタノールが求核攻撃しスタンニル基が脱離して、 -スタンニルスルフィド1と2-シクロヘキセノンをメタノール中で光照射すると、スルフィド1から励起されたシクロヘキセノンに一電子移動が起こり、スルフィド1のカチオンラジカルとシクロヘキセノンのアニオンラジカルとのラジカルイオン対が生成する。さらにこのカチオンラジカルにメタノールが求核攻撃しスタンニル基が脱離して、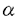 -アルキルチオラジカルが速やかに生成し、これは、シクロヘキセノンのアニオンラジカルとカップリングし、付加体2を与える(式1)。 -アルキルチオラジカルが速やかに生成し、これは、シクロヘキセノンのアニオンラジカルとカップリングし、付加体2を与える(式1)。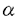 -スタンニルスルフィドの代わりに対応する -スタンニルスルフィドの代わりに対応する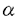 -シリルスルフィドを用いると反応はほとんど進行せず、炭素-スズ結合の切断の容易さが反応の進行に大きな役割をしていることがわかった。メチルおよびフェニルスルフィドのみならず、 -シリルスルフィドを用いると反応はほとんど進行せず、炭素-スズ結合の切断の容易さが反応の進行に大きな役割をしていることがわかった。メチルおよびフェニルスルフィドのみならず、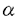 位にスタンニル基を有するジチオアセタールでも反応が進行する。 位にスタンニル基を有するジチオアセタールでも反応が進行する。 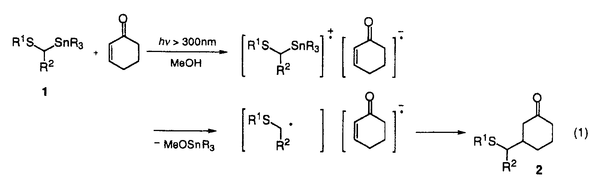 この反応を分子内ラジカル環化に応用した。先の例と同様化合物3を直接光照射を行ったが、環化生成物はほとんど得られなかった。しかし、光増感剤として1,4-ナフタレンジカルボニトリル(DCN)を用いると効率良く反応が進行し、対応する環化生成物4を収率良く得ることができた(式2)。 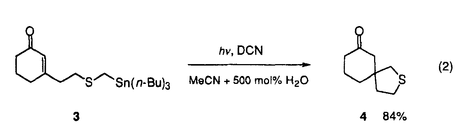 このように、優れた脱離能を有するスタンニル基を持つスルフィドを光-電子酸化することにより、効率よく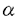 -アルキルチオラジカルが生成し、これが電子不足オレフィンと付加反応することが明らかとなった。 -アルキルチオラジカルが生成し、これが電子不足オレフィンと付加反応することが明らかとなった。 2アルコール溶媒中の光増感反応における1、4-ベンゼンジカルボニトリル類の置換基効果 当研究室では、次式に示すように光増感剤を用いるアセタール5のアセトニトリル-メタノール中での光開環反応において、1,4-ベンゼンジカルボニトリル(DCB)を光増感剤とするよりも、酸化力の弱いと考えられる2-メチル-1,4-ベンゼンジカルボニトリルや2,5-ジメチル-1,4-ベンゼンジカルボニトリルを用いた方が、反応の量子収率がDCBに比べ2-2.3倍に増大することを見出している。筆者は、この一見常識に反するような置換基効果の原因を明らかにできれば、光増感反応を効率化できるのではないかと考えて、このメチル基の導入による反応効率の向上の原因について詳細に検討を行った。 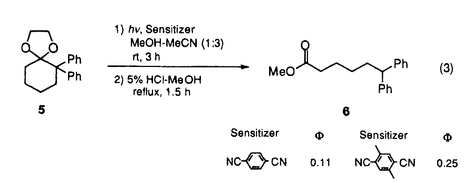 各増感剤のアセタールによる消光定数(Ksv)の値を求めた。アセトニトリル中では、DCBにメチル基を導入するに従ってKsvの値が小さくなるのに対して、アセトニトリル-メタノール(3:l)中では、DCBのKsvの値がアセトニトリル中での値と比べ非常に小さく、メチル基の数が増すに従ってKsvの値が大きくなることがわかった。従ってメチル基の置換基効果は、メタノール中でDCBを増感剤とする場合、アセタールから励起されたDCBへの電子移動がメタノールにより抑制されるのに対し、メチル基を導入するとそれが抑えられることが原因であることがわかった。そこで、増感剤の励起寿命の測定を行ったところ、DCBはアセトニトリル中では9.7nsだが、アセトニトリル-メタノール(3:1)中では0.8nsと10分のl以下に短くなっていることがわかった。一方、メチル-DCBはアセトニトリル中は6.9ns、メタノール中は3.4nsでありあまり変わらない。これらの事実より、アルコール中の反応では、励起されたDCBは溶媒からの電子移動が起こるために短寿命となっている。一方、DCBにメチル基を導入すると励起状態の酸化力が少し低くなり、溶媒による消光が押さえられ、その結果、より反応効率の高い増感剤となっていることがわかった。 3ホウ素のアート錯体の一電子酸化によるアルキルラジカルの生成と反応 アルキルリチウムやグリニャール試薬はカルボニル基などの分極の大きな官能基と反応しやすいのに対し、ラジカル種は分極の小さなオレフィン類などの官能基と反応しやすい。そのため、アルキル金属をアルキルラジカルに変換できオレフィンとの分子間付加反応を効率よく行わせることができれば、合成上有用である。しかしながら、通常、アルキルリチウムやグリニャール試薬を金属化合物で酸化しラジカルを生成させると、金属酸化剤の配位子上での反応や二量化などの副反応が進行し、オレフィンとの付加体を収率良く得ることはできない。そこで、筆者は、アルキル金属からホウ素のアート錯体に変換した後、これを酸化しラジカル種を生成させれば、オレフィンへの付加反応を収率良く行わせることができると考えた。そこで、アルキルリチウムとトリフェニルボランからボラート7を合成し、 -シロキシスチレン存在下7に硝酸アンモニウムセリウム(IV)を作用したところ、アルキルラジカルのオレフィンへの付加体8を得ることができた。ジメチルホルムアミド中低温で反応を行うと、ビフェニルの副生が抑制され良好な収率で付加体8が生成する(式4)。また、電子豊富オレフィンのみならずアクリル酸メチルなどの電子不足オレフィンとも反応し、付加体を与えることがわかった。 -シロキシスチレン存在下7に硝酸アンモニウムセリウム(IV)を作用したところ、アルキルラジカルのオレフィンへの付加体8を得ることができた。ジメチルホルムアミド中低温で反応を行うと、ビフェニルの副生が抑制され良好な収率で付加体8が生成する(式4)。また、電子豊富オレフィンのみならずアクリル酸メチルなどの電子不足オレフィンとも反応し、付加体を与えることがわかった。 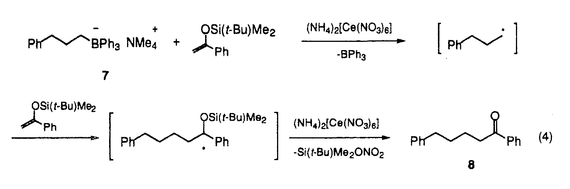 以上、筆者は博士課程において、光電子移動や金属酸化剤を用いた一電子酸化による効率的なラジカル種の生成法と、それを用いる炭素-炭素結合生成への利用を検討した。また、光電子移動反応における光増感剤の重要性に着目し、アルコール溶媒中におけるメチル置換DCBの反応効率の向上の理由を明らかにした。 |