学位論文要旨
| No | 112470 | |
| 著者(漢字) | 大島,拓 | |
| 著者(英字) | ||
| 著者(カナ) | オオシマ,タク | |
| 標題(和) | 大腸菌リジルtRNA合成酵素遺伝子lysUの発現制御機構の研究 | |
| 標題(洋) | ||
| 報告番号 | 112470 | |
| 報告番号 | 甲12470 | |
| 学位授与日 | 1997.03.28 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(理学) | |
| 学位記番号 | 博理第3250号 | |
| 研究科 | 理学系研究科 | |
| 専攻 | 生物化学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | 大腸菌リジルtRNA合成酵素遺伝子、lysUの転写は、様々な環境変化(高温、低pH、ある種のアミノ酸)に応じて促進される一方、大腸菌の多くの遺伝子の転写を制御するグローバルなレギュレーターであるDNA結合蛋白質、LRPおよびH-NSにより抑制される。しかしながら、これらの抑制因子がいかにしてlysU遺伝子の転写を抑制するのかは解明されていない。LRPおよびH-NSによるlysU遺伝子の転写抑制機構の統合的な理解のためには、(1)抑制因子をコードする遺伝子の発現制御機構、(2)抑制因子のオペレーター認識機構の特性、(3)LRP、H-NSそれぞれの転写抑制機構の解析が必要である。本研究では、まず、抑制因子の発現制御機構に焦点をあて、hns遺伝子に比べて、全く解析のなされていなかったlrp遺伝子の転写制御機構について解析した。さらに、LRPのDNA結合特性について解析を行い、LRPおよびH-NSのlysU遺伝子制御領域への結合様式を予測した。この予測をもとに、生化学的にLRPおよびH-NSのlysU遺伝子に対する結合様式と転写抑制活性を解析し、転写抑制モデルを構築することを試みた。 lrp-lacZ融合遺伝子を染色体上に持つ菌株を用いて、lrp遺伝子の制御機構を解析した。染色体上のlrp遺伝子を破壊するとlrp-lacZ融合遺伝子の発現は約1.5倍に増加した。一方、過剰なLRPの導入でlrp-lacZ融合遺伝子の発現量は抑制された。さらに、DNA結合能を欠損したドミナントネガティブ変異LRPの導入により、野性型LRPの有無にかかわらずlrp-lacZ融合遺伝子の発現量は、lrp遺伝子破壊株のレベルまで脱抑制された。これらの結果はlrp遺伝子が自己制御機構を有していることを示す。さらに、lrp遺伝子の詳しい解析によりlrp遺伝子の転写開始点を決定し、その上流に連続するA:Tが規則的に存在し、bent構造をとると予想される領域が存在することを見いだした。そこで、H-NSがbent構造に依存して転写を制御することを考慮し、hns遺伝子破壊株でのlrp遺伝子のmRNA量を定量したところ、野性型株に比べて有為に増加していた。これは、lrp遺伝子がH-NSによっても負の制御を受けていることを示している。さらに、ゲルシフト法を用いて、LRPおよびH-NSがlrp遺伝子上流領域に結合することを確認した。これは2つの因子がlrp遺伝子上流領域へ結合し、直接lrp遺伝子の転写を抑制していることを示唆している。LRPは非常に緩やかな特異的な認識配列に結合するのに対して、H-NSはDNAのbent構造に依存してDNAに結合する。LRPとH-NSが1つの遺伝子の転写を制御している例は、lysUおよびlrp遺伝子の場合と同様に、LRPが転写を促進しているilvIH遺伝子を含む様々な遺伝子で見い出されている。このようなDNA結合特性をもつLRPとH-NSによる転写制御機構が多くの遺伝子で様々に機能しているということは、比較的配列特異的なLRPによる転写制御機構が、異なる特性を持つH-NSによる転写制御により、より転写制御の多様性を増していることを示唆している。 前項で、LRPおよびH-NSのDNA結合部位がそれぞれ構造的に特徴があり、しかも2つの転写制御因子の結合により転写が制御されていることが示唆された。これまでの解析からH-NSはDNAのbent構造へ好んで結合することが知られている。しかしながらLRPの認識配列は決定されておらず、H-NSなどと同様に厳密な認識配列は存在せず、核様体蛋白質として機能しているという考えも存在する。lysU遺伝子の転写抑制モデルの構築には、LRPの認識配列への結合様式を解明する必要がある。そこでLRPの認識機構の特徴を解析した。 LRPの認識機構の特徴を解析するに際して、LRPのDNA結合能の特徴である(1)比較的緩やかな認識配列を持つこと、(2)核様体蛋白質としてゲノム構造の維持に機能する可能性が示唆されていることを考慮した。まず、大腸菌の正確で長く連続した塩基配列を得ることを目標として、日本の大腸菌ゲノムプロジェクト堀内班に参画し、約700kbpの完全な塩基配列を決定した。この塩基配列に対して、既に報告されていた15bpのLRP認識配列に関するマトリックスを用いて15bpごとのLRP結合エネルギーを予測した。この予測では、100kbpにつき約60の高スコアのLRPの認識配列が予測された。しかしながら、精製LRPが特異的に結合しうる部位は、予測されたLRP結合部位から無作為に選んだ12の結合部位のうち、2つのみであった。この2つの結合部位には、それぞれ2つの認識配列が存在し、より特異的な結合をするLRP結合部位は、2つのLRP認識配列をDNAの同じ面に有しており、しかも連続するA:Tが規則的に存在した。このようなLRP結合部位の特徴は、LRPの結合が確認されているlysU遺伝子上流にも確かに見い出された。 最後に、予想されたLRP認識配列とlysU遺伝子上流に存在するbent配列へのLRPおよびH-NSの結合と、転写抑制能について解析した。フットプリント法によると、H-NSが-40から-60までの領域に存在するbent構造に結合し、LRPが前項で予測した-60から-110の領域に存在する2つの認識配列に結合していた。次に、両因子によるlysU遺伝子の転写抑性能について解析した。In vivoでは、LRPおよびH-NSは独立して、lysU遺伝子の転写を抑制していることがlysU-lacZ融合遺伝子を用いた解析で示された。しかも、H-NSの転写抑性能は-40から-60までの領域に、LRPの転写抑制能は-60から-100の領域に依存していた。In vitroにおいても、LRPとH-NSは独立にlysU遺伝子の転写抑制能を示すことが確認された。LRPとH-NSの結合部位の特徴と2つの転写制御因子によるlysU遺伝子の転写制御機構が明らかにされたことにより、両因子がlysU遺伝子の上流の特定の領域を認識して結合し、独立にlysU遺伝子の転写を抑制することが明かとなった。 LRPとH-NSが認識するのはlysU遺伝子上流の-40から-110に存在するbent構造である。プロモーターの上流に存在するbent構造は、プロモーター上流にbent構造を持つgalやlac遺伝子の解析から転写のオープンコンプレックスの形成を促進することが示唆されている。しかも、遺伝子の-35boxから上流に向かって人工的に導入したbent構造が-35boxの役割を担い、しかも、導入されたbent構造依存的にH-NSが下流の遺伝子の転写を抑制することが観察されている。前項までの結果は、両因子がlysU遺伝子のbent構造をとる上流領域に結合し、転写を抑制することを示唆している。本研究では、in vitro転写系を用いて、lysU遺伝子の上流の-40から-60までの領域を欠損した場合、lysU遺伝子の転写能が低下することを示した。このことは、lysU遺伝子上流のbent構造が、オペレーターとともに転写制御部位として機能していることを示している。以下に、その抑制モデルを図として示す。 1.lysU遺伝子上流の-40から-110までの領域に広がるbent構造は、RNAポリメレースと相互作用してオープンコンプレックスの形成を助け、lysU遺伝子の転写を促進する。2.H-NSは-40から-60までの領域に結合し、LRPとは独立にlysU遺伝子の転写を抑制している。この抑制は-40から-60のbent構造とRNAポリメレース、 通常、抑制因子はプロモーター周辺に結合し、転写開始点より40bp以上上流に結合する転写因子は正の転写因子として機能している。lysU遺伝子の転写抑制因子の特徴は抑制因子が-40より上流に結合するにもかかわらず、抑制因子として機能する点である。本研究は、lysU遺伝子の制御因子による転写制御機構に焦点をあて、初めて本格的な分子レベルの解析を実施し、lysU遺伝子のプロモーターの上流に存在するbent構造が転写を促進する機能を持ち、その機能を阻害することによりLRPおよびH-NSが抑制因子として働きうることを初めて示唆した。他方、lysU遺伝子は様々な環境変化に応答して転写が促進されることがしられている。この転写制御機構は、環境要因によるDNA構造の変化による制御によるものと推測されている。本研究で明らかにされたDNAのbent構造の変化に伴う転写制御機構は、この環境要因によるDNA構造の変化による転写制御機構の一端を成していることが期待される。 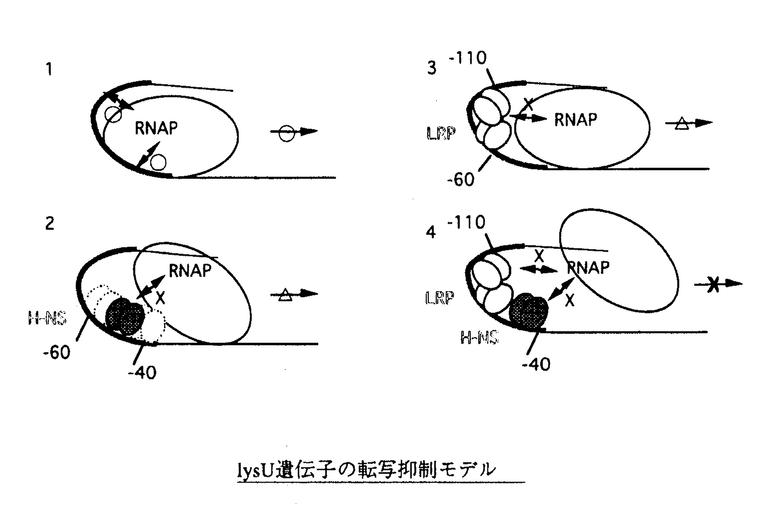 | |
| 審査要旨 | 本論文は、LRPおよびH-NSによる大腸菌リジルtRNA合成酵素遺伝子lysUの転写の抑制機構に焦点をあて、転写制御機構の解析を行ったものである。本論文の実験および解析結果は2、3、4、5章に記述されている。以下にそれぞれの要約を示す。 染色体上のlrp遺伝子を破壊するとlrp-lacZ融合遺伝子の発現は約1.5倍に増加した。この結果はlrp遺伝子が自己制御機構を有していることを示す。さらに、lrp遺伝子の転写開始点の上流にbent構造をとると予想される領域が存在することを見いだした。そこで、H-NSがbent構造に依存して転写を制御することを考慮し、hns遺伝子破壊株でのlrp遺伝子のmRNA量を定量したところ、野性型株に比べて有為に増加していた。これは、lrp遺伝子がH-NSによっても負の制御を受けていることを示している。さらに、LRPおよびH-NSがlrp遺伝子上流領域に結合することを確認した。これは2つの因子がlrp遺伝子上流領域へ結合し、直接lrp遺伝子の転写を抑制していることを示唆している。 大腸菌ゲノムプロジェクトは日本、および米国のグループにより、日本は0min.から時計周りに、米国は反時計周りにシーケンスを進めてきた。本論文では、日本のゲノムプロジェクト、堀内班に参加し、約700kbpの塩基配列を正確に決定した。 3章で決定した、約700kbpの完全な塩基配列を用いて15bpごとのLRP結合エネルギーを予測した。この予測では、100kbpにつき約60の高スコアのLRPの認識配列が予測された。しかしながら、精製LRPが特異的に結合しうる部位は、予測されたLRP結合部位から無作為に選んだ12の結合部位のうち、2つのみであった。この2つの結合部位には、それぞれ2つの認識配列が存在し、より特異的な結合をするLRP結合部位は、2つのLRP認識配列をDNAの同じ面に有しており、しかも連続するA:Tが規則的に存在した。このようなLRP結合部位の特徴は、LRPの結合が確認されているlysU遺伝子上流にも確かに見い出された。 フットプリント法による解析で、H-NSが-40から-60までの領域に存在するbent構造に結合し、LRPが前項で予測した-60から-110の領域に存在する2つの認識配列に結合することが示された。しかも、In vivoでは、LRPおよびH-NSは独立して、なおかつH-NSが-40から-60領域に、LRPが-60より上流の領域に依存してlysU遺伝子の転写抑制能を示した。さらに、In vitroにおいても、LRPとH-NSは独立にlysU遺伝子の転写抑制能を示すことが確認された。この結果、両因子がlysU遺伝子の上流の特定の領域を認識して結合し、独立にlysU遺伝子の転写を抑制することが明かとなった。 本論文で示された結果は、両因子がlysU遺伝子のbent構造をとる上流領域に結合し、転写を抑制することを示唆している。しかしながら、通常の転写抑制因子はプロモーター周辺に結合することにより転写を抑制していると考えられている。それに対して、LRPとH-NSが結合するのはlysU遺伝子上流の-40から-110に存在するbent構造である。したがって、lysU遺伝子における転写抑制因子の抑制機構は他のメカニズムを持つことを本論文では提唱している。それは、プロモーター上流に存在するbent構造が、転写を促進し、抑制因子が、その転写の促進を阻害するというメカニズムである。 本研究は、lysU遺伝子の制御因子による転写制御機構に焦点をあて、初めて本格的な分子レベルの解析を実施し、lysU遺伝子のプロモーターの上流に存在するbent構造が転写を促進する機能を持ち、その機能を阻害することによりLRPおよびH-NSが抑制因子として働きうることを初めて示唆した。この結果はlysU遺伝子の発現制御機構の単なる解析にとどまらず、新たな転写制御機構を提唱している点で学術的にも重要な貢献をするものと認められる。このため、大島拓は博士(理学)の学位をうけるのに十分な資格があるものと判断された。なお本論文第2章は伊藤耕一、樺山博之、中村義一との、第3章は大腸菌ゲノムプロジェクトメンバーとの共同実験であるが、論文提出者が主体となって分析および検証をを行ったもので、論文提出者の寄与が十分であると判断した。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/53953 |
 -サブユニットとの相互作用を阻害していると予想される。3.LRPはH-NSよりさらに上流に4量体を作って結合し、この領域に存在するbent構造とRNAポリメレースとの相互作用を阻害し、オープンコンプレックスの形成を阻害していると予想される。4.2.および3.に示された、H-NSおよびLRPの抑制能は、互いに異なる領域に依存している。この異なる領域に2つの因子が同時に結合することにより、lysU遺伝子の転写は完全にシャットオフされる。
-サブユニットとの相互作用を阻害していると予想される。3.LRPはH-NSよりさらに上流に4量体を作って結合し、この領域に存在するbent構造とRNAポリメレースとの相互作用を阻害し、オープンコンプレックスの形成を阻害していると予想される。4.2.および3.に示された、H-NSおよびLRPの抑制能は、互いに異なる領域に依存している。この異なる領域に2つの因子が同時に結合することにより、lysU遺伝子の転写は完全にシャットオフされる。