分裂酵母には唯1つのras遺伝子ras1が見つかっている。一倍体ras1遺伝子破壊株においては、接合がおこらず、人為的に作製した二倍体ras1遺伝子破壊株では胞子形成率に著しい低下が見られる。また、分裂酵母の野生型株は円筒形をしているのに対しras1遺伝子破壊株は異常な細胞形態をしており、形態が太く、短くなっている。 Ras1の下流には2つの細胞内情報伝達系路が存在することが示されている。1つはByr2/Ste8、Byr1/Ste1、Spk1からなるMAPキナーゼカスケードである。これらの遺伝子の一つを欠損した株は、接合及び胞子形成不能の表現型を示すが、細胞形態に異常は見られない。もう1つはRal1/Scd1、Ral3/Scd2、Cdc42Sp、Pak1/Shk1からなるGTPaseカスケードである。Cdc42Spは出芽酵母Cdc42のホモログであり、Rhoファミリーに属する低分子量GTPaseである。Ral1は出芽酵母Cdc24のホモログであり、Cdc42Spのグアニンヌクレオチド交換因子であると考えられている。Ral3は出芽酵母Bem1のホモログである。Ral3はRas1、Ral1およびCdc42Spの全てと相互作用し、これらのタンパク質の行う情報伝達を容易にしている足場タンパク質(scaffold protein)であると考えられている。Ral1、Ral3欠損株は、ともに細胞形態が異常で、接合不能であるが、二倍体の胞子形成には大きな異常はない。Pak1は高等動物のCdc42/Rac1結合タンパク質であるp65PAK及び出芽酵母Ste20キナーゼのホモログであり、Cdc42Spにより活性化される。cdc42s pとpak1の遺伝子破壊株は致死性を示し、その終末表現型は細胞形態が丸くなる。このように、後者の情報伝達系は基本的に接合及び細胞形態の維持に関与しており、前者は接合と胞子形成に関与していると考えられる。 真核生物においてRhoファミリーに属するGTPaseは一般的に細胞内のアクチンの編成に関与していることが示されており、分裂酵母においてRas1-Cdc42Spの情報伝達系がどのようにして細胞骨格系を制御し細胞形態を維持しているのかを解明することは興味深い。そこでRas1-Cdc42Spカスケードに関与する新たな因子の同定を目的にral3遺伝子破壊株の接合不能を多コピーで抑圧するプラスミドの単離を分裂酵母cDNAライブラリーから試みた。その結果、接合能を抑圧する遺伝子は得られなかったが、一倍体ral3遺伝子破壊株を二倍体化させ、胞子形成に導くプラスミドを単離した。このプラスミドは、分裂酵母type II myosin heavy chainのC端のcoiled coil領域をコードするcDNAを含んでいた。このtype II myosin heavy chainは分裂酵母で最初に見つかったmyosin heavy chainであり、その遺伝子をmyo2と名付けた。 myo2による細胞の二倍体化はral1遺伝子破壊株でも観察された。myo2による細胞の倍数体化はral1+ral3+の遺伝子型をbackgroundに持つ細胞でも見られたが、その率は一桁低く、Myo2とRal1-Ral3が遺伝学的に相互作用することが示された。 myo2遺伝子はイントロンのない1526アミノ酸をコードしうる一つのORFを持っていた。Myo2は全長に渡って、他の生物で見つかっているtype II myosin heavy chainと相同性を持つ。Head部位は特に相同性が高い。Head部位を他の生物のmyosin heavy chainのアミノ酸配列と比較したところ分裂酵母Myo2の150残基目から188残基目までにATP結合部位と考えられる配列が、634残基目から655残基目までにはアクチン結合部位と考えられる配列が見つかった。 Myo2には、765残基目から775残基目までに1個のIQモチーフのコンセンサス配列と一致する部位が見つかった。IQモチーフとは、myosin light chainの結合部位と考えられる配列であり、そのコンセンサス配列はIQXXXRGXXXRである。ほとんど全てのtype II myosin heavy chainは2個のIQモチーフを持つ。type II myosinは通常、2個のheavy chain、2個のregulatory light chain、2個のessential light chainの6量体で働く。そのため、1つのheavy chainはIQモチーフを2ヶ所に持ち、それぞれにlight chainを結合する。Myo2にはIQモチーフのコンセンサス配列と一致するアミノ酸配列は、1ヶ所しか見つからなかった。分裂酵母では、myosin light chainをコードすると考えられる遺伝子、cdc4がMcCollumらにより単離されている。Cdc4は約200kDaのタンパク質と複合体を作ることが免疫沈降実験により確認されている。この200kDaのタンパク質はmyosin heavy chainであると推定されている。この200kDaの蛋白質はMyo2である可能性が考えられるが、彼らの免疫沈降実験では200kDaのmyosin heavy chainと考えられるタンパク質の他にもう1つのmyosin light chainと考えられる共沈タンパク質は得られていない。このれらのことから、Myo2はtype II myosinであるにも関わらず、1つのlight chainのみを伴って働く特殊なtype II myosinである可能性が考えられた。 Myo2のtail部位には9個のプロリン残基が存在する。プロリンが存在するとその部位で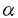 -ヘリックス構造が壊れるため、coiled coil構造がとりにくくなる。このため、type II myosinのtail部位にはプロリン残基はほとんど見られない。Acanthamoebaのtype II myosinのtail部位にはプロリン残基が1つ存在する。電子顕微鏡での解析によると、このプロリンがあると考えられる位置でAcanthamoeba type II myosinのtailは鋭く折れ曲がっている。Myo2のプロリンの位置は大きく4ヶ所に位置しており、Myo2のtail部位はこの4ヶ所で折れている可能性が考えられる。 -ヘリックス構造が壊れるため、coiled coil構造がとりにくくなる。このため、type II myosinのtail部位にはプロリン残基はほとんど見られない。Acanthamoebaのtype II myosinのtail部位にはプロリン残基が1つ存在する。電子顕微鏡での解析によると、このプロリンがあると考えられる位置でAcanthamoeba type II myosinのtailは鋭く折れ曲がっている。Myo2のプロリンの位置は大きく4ヶ所に位置しており、Myo2のtail部位はこの4ヶ所で折れている可能性が考えられる。 myo2遺伝子破壊株は致死性を示した。細胞内からMyo2が枯渇すると、細胞長が伸長し多くの分離していないセプタム(細胞隔壁)が均等な間隔を置いて存在する細胞が観察された。セプタムに区切られた全てのコンパートメントの中には核が一つずつ存在していた。細胞内のF-アクチンの局在は正常であった。これらのことからmyo2遺伝子破壊株の終末表現型はセプタム形成後の細胞の不分離であると結論した。 強力なnmt1プロモーターの制御下でmyo2遺伝子を発現するプラスミドを構築し、myo2遺伝子を分裂酵母野生型株で過剰発現させたところ細胞の増殖が阻害された。myo2の過剰発現株ではアクチンの再分配が妨げられているようであり、細胞質分裂が起こらずに細胞の体積増加と核分裂が進行し、細胞の両端が膨れてダンベルのような形態をした巨大な多核細胞を形成した。 クラゲのgreen fluorecent protein(GFP)遺伝子をmyo2遺伝子のN-端に結合し、分裂酵母内でのGFP-Myo2の局在を調べた。GFP-Myo2はM期前期に細胞表層の赤道面に集まり、核をまたいだ形で環状構造を形成することがわかった。Phalloidin-TRITCによるアクチンの染色から、GFP-Myo2の環状構造はアクチンの環状構造と局在が一致しており、アクチンとMyo2はこの位置で分裂酵母の収縮環を形成していることが示唆された。さらに、GFP-Myo2の経時的観察から、有糸分裂が進み核が2個に分かれるとGFP-Myo2の環状構造はその直径を狭め、最終的には細胞の中央に1個の点になる事が明らかになった。GFP-Myo2が点となったときには、Nomarski顕微鏡での観察によりセプタムが形成されていることが確認された。GFP-Myo2の局在は、Myo2が分裂酵母の収縮環を構成し、細胞質分裂装置として働いていることを強く示唆している。 type II myosinは高等動物の筋肉細胞でアクチン繊維と共同して働き、筋肉の収縮を引き起こすモータータンパク質として有名である。また、非筋細胞においては細胞質分裂時にアクチン繊維とともに収縮環に存在し、細胞質をくびれさせている。さらに、最近の知見ではtype II myosinは細胞運動にも関与していることが知られている。本研究では、分裂酵母type II myosinが分裂酵母の収縮環に存在することを明らかにし、Myo2が分裂酵母の細胞質分裂の課程で働いている可能性を示した。type II myosinが細胞質分裂の重要な装置であることは多くの生物で示されているが、その制御機構は未だ明らかではない。分裂酵母は遺伝学的な解析が容易なため、本研究は今後、type II myosinの制御機構を明らかにするために、非常に興味深い材料を提供していると考えられる。 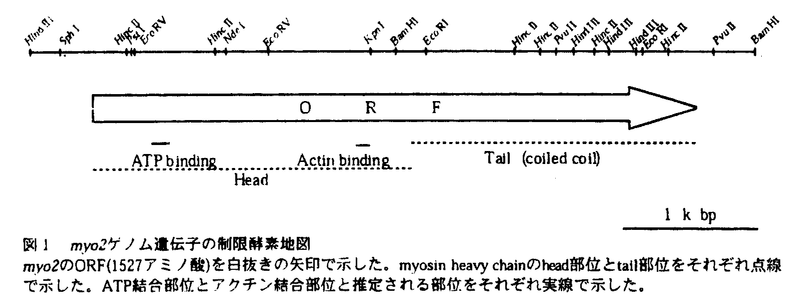 図1 myo2ゲノム遺伝子の制限酵素地図myo2のORF(1527アミノ酸)を白抜きの矢印で示した。myosin heavy chainのhead部位とtail部位をそれぞれ点線で示した。ATP結合部位とアクチン結合部位と推定される部位をそれぞれ実線で示した。 図1 myo2ゲノム遺伝子の制限酵素地図myo2のORF(1527アミノ酸)を白抜きの矢印で示した。myosin heavy chainのhead部位とtail部位をそれぞれ点線で示した。ATP結合部位とアクチン結合部位と推定される部位をそれぞれ実線で示した。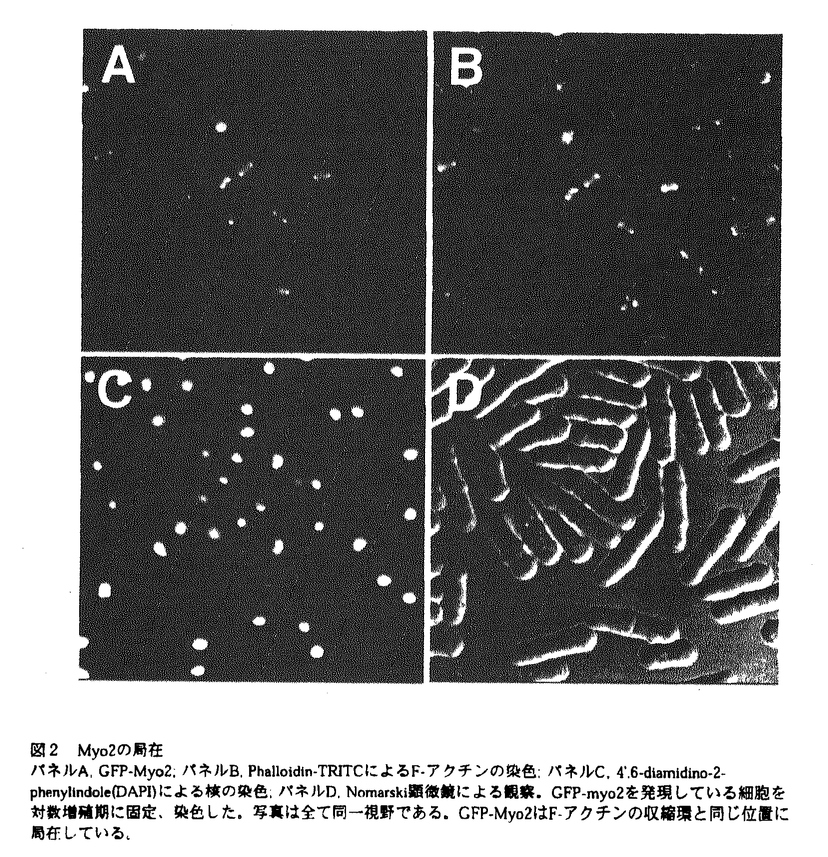 図2 Myo2の局在パネルA,GFP-Myo2;パネルB,Phalloidin-TRITCによるF-アクチンの染色;パネルC,4’.6-diamidino-2-phenylindole(DAPI)による核の染色;パネルD,Nomarski顕徴鏡による観察。GFP-myo2を発現している細胞を対数増殖期に固定、染色した。写真は全て同一視野である。GFP-Myo2はF-アクチンの収縮環と同じ位置に局在している。 図2 Myo2の局在パネルA,GFP-Myo2;パネルB,Phalloidin-TRITCによるF-アクチンの染色;パネルC,4’.6-diamidino-2-phenylindole(DAPI)による核の染色;パネルD,Nomarski顕徴鏡による観察。GFP-myo2を発現している細胞を対数増殖期に固定、染色した。写真は全て同一視野である。GFP-Myo2はF-アクチンの収縮環と同じ位置に局在している。 |