ペプチド:N-グリカナーゼ(PNGase)は、図1に示す反応を触媒する酵素である。即ち、糖タンパク質N型糖鎖の根元のGlcNAc残基とAsn残基の間のアミド結合を切断し、最終的に還元末端にN,N’-ジアセチルキトビオース構造を保持した遊離糖鎖と糖結合Asn残基がAsp残基に変換した脱糖鎖タンパク質を等モル量生じる。  図1.PNGaseが触媒する糖タンパク質N型糖鎖脱離の反応R1:オリゴ糖鎖;R2,R3:ペプチド鎖 図1.PNGaseが触媒する糖タンパク質N型糖鎖脱離の反応R1:オリゴ糖鎖;R2,R3:ペプチド鎖 本酵素活性は1977年高橋によってアーモンド中に見い出されて以来細菌からも単離され、N型糖鎖の構造及び機能研究に有用な試薬として広く用いられてきた一方で、酵素自体の生物学的機能については長い間注目されることが無かった。 PNGaseの動物細胞における存在例は1991年に瀬古らによってメダカ胚に見い出されたのが最初である。以来、我々は本酵素の触媒するDe-N-glycosylation反応をタンパク質の翻訳後の再修飾反応(remodification)として位置づけ、この反応が実際に生体内で基質糖タンパク質の物理化学的、あるいは生理学的性質の変化を通じてその機能発現および調節に関与していることを提唱してきている(図2)。 私は本研究科修士課程において本酵素活性の微量な活性同定、検出法を確立した。この検出法によって、PNGaseは様々な組織および培養細胞の可溶性画分に存在し、活性の至適pHが中性であること等を明らかにした。本研究はこの動物細胞に遍在するPNGaseの生理機能を解明することを目的として行われ、以下の[1]から[3]に示す結果が得られた。 [1]L-929PNGaseの完全精製及び酵素学的諸性質 マウス由来の繊維芽細胞であるL-929細胞の可溶性画分に見い出されたPNGaseを疎水性クロマトグラフィー及びゲル濾過クロマトグラフィーによって完全精製し、L-929PNGaseと名付け、酵素の諸性質を調べた。本酵素は糖鎖を持たず、分子量はゲル濾過の溶出位置から212,000と推定され、SDS電気泳動の移動度からは105,000と見積られた。このことから本酵素は単一サブユニットのホモダイマーを形成していることが示唆された。また、本酵素活性はジチオスレイトール等の還元剤要求性であり、モノヨード酢酸やN-エチルマレイミドは活性を阻害することから、活性の発現に-SH基が関与していると考えられた。 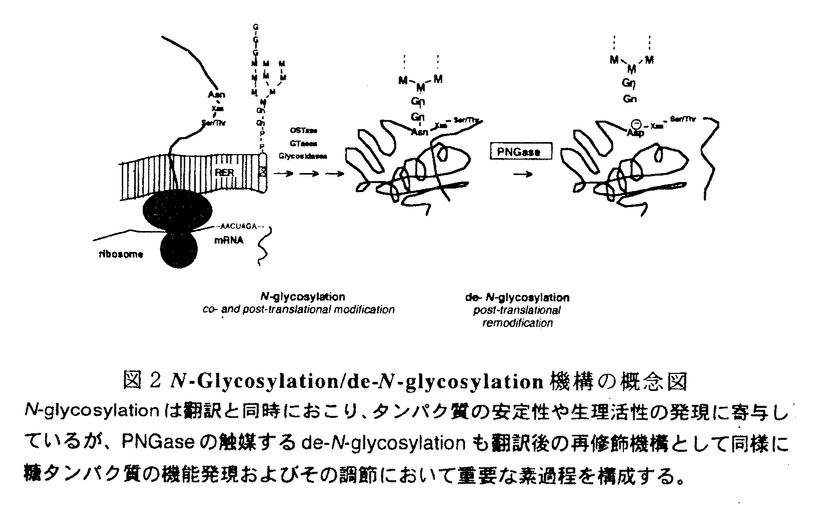 図2N-Glycosylation/de-N-glycosylation機構の概念図N-glycosylationは翻訳と同時におこり、タンパク質の安定性や生理活性の発現に寄与しているが、PNGaseの触媒するde-N-glycosylationも翻訳後の再修飾機構として同様に糖タンパク質の機能発現およびその調節において重要な素過程を構成する。 図2N-Glycosylation/de-N-glycosylation機構の概念図N-glycosylationは翻訳と同時におこり、タンパク質の安定性や生理活性の発現に寄与しているが、PNGaseの触媒するde-N-glycosylationも翻訳後の再修飾機構として同様に糖タンパク質の機能発現およびその調節において重要な素過程を構成する。 L-929PNGaseの至適pHは7.0であり、酵素の反応産物である遊離糖鎖によって活性が阻害される等、既知のPNGase(アーモンド由来PNGaseA;Flavobacteriummemingosepticuum由来PNGase F)とは異なる性質を示した。また本酵素は2価陽イオンを要求せず、Zn2+,Cu2+,Fe3+の各種イオンによって阻害をうけた。また、糖アスパラギンによっても強い阻害をうけた。至適イオン強度は0.05であった。温度依存性については、30℃で活性の最大値を示し、その安定性は、37℃以上で安定性の急激な低下が見られた。 L-929PNGaseの14C標識フェツイン糖ペプチドIに対する反応速度論的解析を行ったところ、Lineweaver-Burkプロットは直線性を示し、グラフよりKm値は114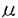 Mと求められた。同一基質を用いてPNGase AおよびPNGase FのKmを求めて比較したところ、それぞれ1.46mMおよび525 Mと求められた。同一基質を用いてPNGase AおよびPNGase FのKmを求めて比較したところ、それぞれ1.46mMおよび525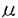 Mと求められ、L-929PNGaseがこれらと比較して基質との高い親和性を持つことが示唆された。 Mと求められ、L-929PNGaseがこれらと比較して基質との高い親和性を持つことが示唆された。 L-929PNGaseは高マンノース型、混成型、複合型糖鎖を持つ糖ペプチドに作用し、幅広い基質特異性を示したが、根元のGlcNAcに 1→3或いは 1→3或いは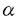 1→6でFucが結合している基質には反応性を示さなかった。また糖鎖部分がGlcNAc1残基のみの糖ペプチドや糖アスパラギンには全く作用しなかった。糖タンパク質に対する反応性については4種類の基質(ウシ膵臓リボヌクレアーゼB、ウシ胎児血清フェツイン、ヒト血清トランスフェリン、ニワトリ卵白オボアルブミン)に対して調べたところ、糖鎖の切断は確認されなかった。 1→6でFucが結合している基質には反応性を示さなかった。また糖鎖部分がGlcNAc1残基のみの糖ペプチドや糖アスパラギンには全く作用しなかった。糖タンパク質に対する反応性については4種類の基質(ウシ膵臓リボヌクレアーゼB、ウシ胎児血清フェツイン、ヒト血清トランスフェリン、ニワトリ卵白オボアルブミン)に対して調べたところ、糖鎖の切断は確認されなかった。 【2】L-929PNGaseの糖鎖結合活性の解析 以上の研究で明らかになったL-929PNGaseは、上述したようにいくつかの点で他の既知のPNGaseとは異なる性質を有している。中でもL-929PNGaseに見い出された酵素反応産物である遊離糖鎖による活性の阻害は、酵素の糖鎖結合タンパク質としての性質を示唆しており、酵素の生理学的作用においてもきわめて重要な性質と考えられたので更に詳細に解析した。まず種々の構造を持つ遊離糖鎖および関連物質が酵素活性に与える影響を調べたところ、トリマンノシド-N,N’-ジアセチルキトビオース構造(Man3GlcNAc2)を持つ糖鎖で強い阻害効果が見られた(K1=〜10-5M)。また阻害効果のある糖鎖構造の最小ユニットはトリマンノース(Man3)あるいはN,N’-ジアセチルキトビオース(GlcNAc2)であった。既知の酵素と比較して、GlcNAc2は共通の阻害剤であるのに対し、Man3はL-929PNGaseに特異的な阻害剤であることが分かった。Dixonプロットによる解析を行った結果、GlcNAc2は基質の拮抗阻害剤として作用しているのに対し、Man3は基質結合部位とは別の部位に結合していることが示された。 酵素と糖鎖の結合を直接調べる為に、酵母マンナン-Sepharose 4Bカラムとの結合を調べた結果、L-929PNGaseは同カラムに結合することが明らかとなった。この性質もL-929PNGase特有のものであった。また3Hあるいは14Cでラベルされた還元オリゴ糖鎖及び糖アスパラギンを用いて酵素との結合定数を求めたところ、糖鎖の種類(高マンノース型、複合型)によらずKd=〜10-5Mであった。Scatchardプロットの解析によって、この糖鎖はダイマー酵素あたり2箇所の結合部位を持つことが分かった。この糖鎖結合活性は-SH基修飾試薬によって酵素を失活させた条件下でも保たれており、Man3によって濃度依存的に阻害されるのに対しGlcNAc2にその効果は見られなかった。 [3]ニワトリ輸卵管PNGase(PNGase HO)による内在性基質、Over-glycosylated ovalbumin(OG-OVA)の部位特異的de-N-glycosylation 動物細胞の可溶性画分に普遍的に存在するPNGaseの生物学的機能を知るには、酵素の生理学的、即ち内在性基質を同定し、それに対する作用を知る必要がある。ここで、通常その分子中にN型糖鎖を一本持つオボアルブミンの一部が生合成の過程で一過的に糖鎖を2本持つオボアルブミン(Over-glycosylated ovalbumin;OG-OVA)として合成されることが報告されていたので、私はこのOG-OVAが消失する過程にPNGaseの反応が関与しているのではないかと考え、ニワトリ輸卵管に存在するであろうPNGaseとオボアルブミンの生合成過程におけるこの酵素の関与についての研究を行った。 まずニワトリ輸卵管のPNGaseを精製を行った。本酵素は疎水性クロマトグラフィー及びゲル濾過クロマトグラフィーによって粗酵素画分より1000倍精製され、PNGase HOと名付けられた。PNGase HOは、至適pHを中性付近に持ち、その活性に-SH基を必要とする等、動物組織に広く存在する可溶性中性PNGaseと共通の性質を持つことが確かめられた。 更にOG-OVAを輸卵管組織中で3H-マンノース代謝標識後、陽イオン交換、ゲル濾過及びCon A親和性クロマトグラフィーによって精製し、in vitroにおいてPNGase HOとの反応性を反応産物の解析によって調べた。その結果、この酵素反応によってOG-OVAから定量的に一本の糖鎖が外れることが明らかとなり、更に反応産物の解析を行ったところ糖鎖の脱離は部位特異的であり、専らOG-OVAにおいて余分に付加されたAsn-311から糖鎖が外れていることが明らかとなった。一方、通常のオボアルブミンが持つAsn-292の糖鎖は、正常の卵白オボアルブミンを用いても酵素との反応性を示さなかった。これらの結果を考えあわせると、可溶性中性PNGaseは、動物細胞において糖鎖の過剰修飾のような異常タンパク質を(a)正常の機能性タンパク質に修復する、あるいは(b)分解経路に導く役割を持つこと、即ち糖タンパク質の新しい品質管理(quality control)機構に関与する可能性が示唆された。 |