| 内容要旨 | | 本研究は,相同組換え反応時に形成される特徴的なDNAの構造を初めて,原子座標レベルで明らかにしたものである.それは既によく知られているA-form,B-form,Z-form等の構造とは異なる新規なものであり,しかも,生物学的にも非常に意義深いものである.NMRによる構造解析の結果,我々は相同組換え酵素RecAタンパク質に結合したDNAは,新規のdeoxyribose-baseスタッキングにより,通常のDNAより引き伸ばされた構造をとっているという証拠を得た.また,この構造は柔軟に運動しやすい性質を持っており,この柔軟性が単鎖DNAと二重鎖DNAとの間の塩基対を交換するという動的な反応を可能にさせる要因となっていると想定される.このDNA構造の解明によって,相同組換えの反応機構を分子構造レベルで検証することが可能となった. 相同組換えタンパク質に結合したDNAの特異な構造およびそのNMR解析 大腸菌RecAタンパク質は生体内で遺伝的組換えに必須であり,そのホモログは広く人間にまでわたって存在している.RecAタンパク質は,ATPを補助因子とし,単鎖DNA上に協同的に結合し,フィラメント状の前駆体を形成する.その前駆体は,他の二重鎖DNAとの間で,相同的塩基配列を探索し,対合させ,相同なDNA鎖を交換する反応を促進させる. RecAタンパク質については単独あるいはADP複合体でのX線解析の例はあるが,DNAとの複合体での構造解析例は未だ報告されてない.RecAタンパク質-DNA複合体についての電子顕微鏡の観察によると,RecAフィラメント内の単鎖及び二重鎖DNAはB型DNAの1.5倍に引き延ばされ,約18.6bp/turnに巻き戻されて見える.しかし,実際のタンパク質-DNA間の相互作用は水溶液中の運動の激しい条件下で起こる現象であり,そのような動的性質を含んだ情報はX線解析,電子顕微鏡では得られない.生理的条件下で実際に行われている相同対合の分子機構を理解するためには,水溶液中でのNMRによる解析が必要である.ところが,RecAタンパク質あるいはRecAタンパク質とDNAの複合体のような巨大分子をNMRによって解析することはシグナルのブロードニングを招き,共鳴線の分離が困離となる等,大きな困難を伴う.事実,RecAタンパク質あるいはそのDNA複合体をNMR実験の対象として成功している例は,これまで一例もなかった. RecAタンパク質はDNAの周りを高い協同性で多量体形成し,安定な複合体を作るが,DNA自身との結合は非常に弱く,特に短いDNAオリゴマーとのアフィニティは非常に低いことが知られている.我々は,この性質を利用することによって,RecAタンパク質とDNAとの相互作用をNMRによって解析することができると考えた.すなわち,基質として短いDNAオリゴマー(3-6塩基)を用い,DNAが速い速度で結合・解離する化学交換の存在下でNOE測定を行うtransferred nuclear Overhauser effect(TRNOE)実験を行うことによってRecAタンパク質に結合したDNAの構造情報を得ることができると考えたわけである.この手法は小分子が速い交換速度で巨大分子と結合・解離をおこしている実験系において幅広く適応され,巨大分子に結合した小分子の構造を解析することに有用であることが示されている. 1DNOE差スペクトル DNAオリゴマーとATP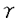 Sとを含む溶液にRecAタンパク質を加えることにより,1DNOE差スペクトル上でTRNOE由来のシグナルを観察した(図1a).これらのNOEはRecAタンパク質添加前は非常に小さいものであり(図1c),RecAタンパク質によって誘起されたものである.RecAは補助因子としてADPを用いるとDNAに対して,親和性が減少することが知られている.実際にATP Sとを含む溶液にRecAタンパク質を加えることにより,1DNOE差スペクトル上でTRNOE由来のシグナルを観察した(図1a).これらのNOEはRecAタンパク質添加前は非常に小さいものであり(図1c),RecAタンパク質によって誘起されたものである.RecAは補助因子としてADPを用いるとDNAに対して,親和性が減少することが知られている.実際にATP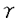 SをADPに置換することによって,TRNOEの強度が抑制された(図1b).このことは,結合状態のDNAオリゴマーのフラクションがATP SをADPに置換することによって,TRNOEの強度が抑制された(図1b).このことは,結合状態のDNAオリゴマーのフラクションがATP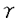 SをADPに置換することによって減少したことを示唆する.また同様に,RecAタンパク質はRNAに対して,親和性が低いことが実験によって示されている.我々はDNAをそれに対応する塩基配列を持つRNAに置換することによってTRNOEシグナルの強度が有意に減少することを観察した(図1d) SをADPに置換することによって減少したことを示唆する.また同様に,RecAタンパク質はRNAに対して,親和性が低いことが実験によって示されている.我々はDNAをそれに対応する塩基配列を持つRNAに置換することによってTRNOEシグナルの強度が有意に減少することを観察した(図1d) 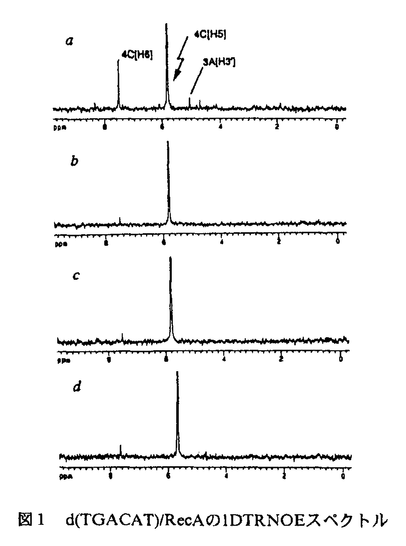 図1 d(TGACAT)/RecAの1DTRNOEスペクトル残基間NOEの特異的な特徴 図1 d(TGACAT)/RecAの1DTRNOEスペクトル残基間NOEの特異的な特徴 RecA-DNA溶液のTRNOESYスペクトルには典型的なB型DNAやA型DNAに観察されるものとは異なったクロスピークが示されている.典型的なB型DNAのNOESYスペクトルにおいては,H1’(i)とH8/H6(i+1)との間に強いクロスピークが,H3’(i)とH8/H6(i+1)との間に弱いクロスピークが観察されるはずである.それに反して,2DTRNOESYスペクトルには残基間のH1’(i)-H8/H6(i+1)クロスピークは非常に小さく,一方,残基間のH3’(i)-H8/H6(i+1)クロスピークは異常に強いものであった(図2b).A型DNA構造は強い残基間クロスピークH2’(i)-H8/H6(i+1)によって特徴づけられるが,我々はほぼ同じ強度の比較的弱い残基間H2’(i)-H8/H6(i+1),H2"(i)-H8/H6(i+1)NOEを観察した(図2a).これらは典型的なA型あるいはB型DNAに期待されるものとは著しく異なるもので,RecAタンパク質に結合した単鎖DNAが特異的な構造をとっていることを示している. 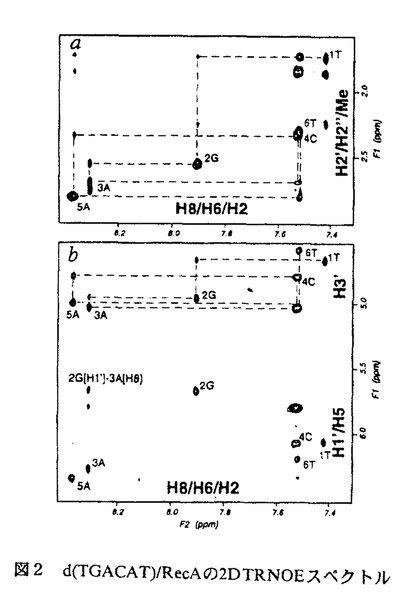 図2 d(TGACAT)/RecAの2DTRNOEスペクトル緩和行列計算による残基内NOEの解析 図2 d(TGACAT)/RecAの2DTRNOEスペクトル緩和行列計算による残基内NOEの解析 残基内のH8/H6-H2’,H8/H6-H1’,H8/H6-H3NOEは塩基の配向と糖のパッカリングを決定するのに重要なクロスピークである.残基内のH8/H6-H2’NOEの強度は残基内H8/H6-H1’,H8/H6-H3’NOEに比べて,より強い.このことはRecAに結合したDNAは主にS-type(C2’-endo樣),anti構造を取っていることを示している.しかし,残基内H8/H6-H1’,H8/H6-H3’NOEは純粋なC2’-endo,anti構造に期待されるものよりもより強いため,C3’-endoやsynコンフォメーションがいくらかTRNOESYスペクトルに寄与していると考えられる.そこで,RecAタンパク質に結合したDNAがC2’-endoとC3’-endo,antiとsyn構造の混合状態にあると考え,各々の構造をモデリングし,緩和行列計算を行った.さらに,実際のTRNOEbuildupcurveに対してフィッティングを行うことにより,それぞれの構造のTRNOEスペクトルに対する寄与を評価した.その結果,フラノース環のパッカリングとグリコシジル結合角をC2’-endoとC3’-endo,antiとsynそれぞれ適当な比率で計算することによって,実測値と良く合った結果を得ることができた.結合状態の構造として一型を仮定した計算結果に比べて,実測値と理論値の適合性は非常に良く改善された. RecAタンパク質に結合した単鎖DNAの構造模型 図3にTRNOEデータから導かれたRecAタンパク質に結合したDNAの構造モデルを示す.最も顕著な構造上の特徴はそのスタッキング様式にある.典型的なDNAでは塩基と塩基との間がファンデルワールス接触しているのに対し,RecA結合型DNAではデオキシリボースのC2’-H2’-H2"部位が次の残基の塩基部位の上方に位置している.このdeoxyribose-baseスタッキング相互作用は疎水的相互作用によって構造全体の安定化に寄与していると思われる.もし,RecAフィラメントに対するらせん軸を塩基面とほぼ垂直に設定すると,塩基間の距離は約5Åとなり,これはB型DNAの約1.5倍に相当する. 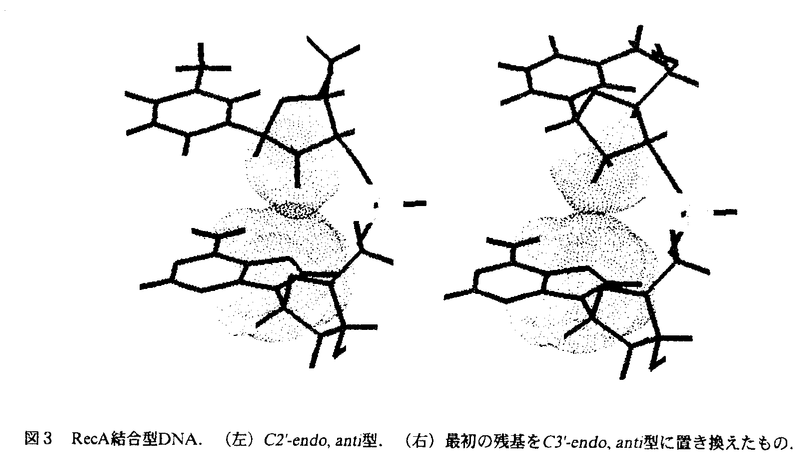 図3 RecA結合型DNA.(左)C2’-endo,anti型.(右)最初の残基をC3’-endo,anti型に置き換えたもの. 図3 RecA結合型DNA.(左)C2’-endo,anti型.(右)最初の残基をC3’-endo,anti型に置き換えたもの. 緩和行列解析の結果,RecAタンパク質に結合したDNAは溶液中で複数の異なる構造を移り変わっていることが示された.我々はこのうち,糖のパッカリングがS-type(nearC2’-endo)とN-type(nearC3’-endo)との間を移り変わる相互変換がDNAの引き伸ばされた構造中で頻繁に起こっており,このことが相同認識や鎖交換反応の過程で必要な塩基の回転と密接な関連があると考えている. 現在の生物の殆ど全てはDNAを遺伝情報伝達物質として用いている.RNAをゲノムとして用いている例はRNAウイルス等,僅かな例に過ぎない.この理由として,RNAには無いDNAのH2"がDNAに化学的安定性をもたらし,それゆえDNAの方が遺伝情報保存の場として有利であるという説明が,広く受け入れられてきている.我々の結果はデオキシリボースのC2’-H2’-H2"部位と次の残基の塩基部位との残基間相互作用がDNAの引き伸ばされた構造の主要因であり,相同組換え反応を効率よく遂行させる鍵であることを示唆している.遺伝情報の保存という役割に加えて,DNAのH2"は遺伝子の再編成と多様化(つまり,遺伝的組換え)においても重要な役割を担っているのではないだろうか.我々はこの立体化学的利点が進化の過程で遺伝物質に要求されたのではないかと想像している.そしてそれはDNAに内在しているものであったのだが,RNAには無かったものなのであろう. |
| 審査要旨 | | 大腸菌RecAタンパク質は生体内で相同組換えの中心的役割を果たすタンパク質として知られており,他の真核生物の相同組換え酵素の原型として知られている.RecAタンパク質は,ATPを補助因子とし,単鎖DNA上に協同的に結合し,フィラメント状の複合体を形成する.その複合体は,他の二重鎖DNAとの間で,相同的塩基配列を探索し,対合させ,相同なDNA鎖を交換する反応を促進させる.RecAタンパク質-DNA複合体についての電子顕微鏡の観察によると,RecAフィラメント内の単鎖及び二重鎖DNAはB型DNAの約1.5倍に引き伸ばされ,約18.6bp/turnに巻き戻されて見える.しかし,RecAタンパク質は単独あるいはADP複合体でのX線解析の例はあるが,DNAとの複合体での構造解析例はこれまで報告されていなかった. 本論文は大腸菌RecAタンパク質に結合した単鎖DNAの構造をNMR法を用いることによって初めて明らかにしたものである.しかも,それは今まで知られている既知の構造とは異なる新規なものであり,その組換え反応に対する意義についても興味深いものである.本論文の第1章は,これまで知られているRecAタンパク質およびRecAタンパク質に結合したDNAの構造の特徴について概説したものである.第2章ではNMR実験を行うために適切な溶媒条件について検討を行っている.第3章において実際のtransferred NOE(TRNOE)法によるNMR解析について報告しており,第4章では,今回のNMR解析についての討論と,この解析によって得られた知見に基づき,組換え酵素タンパク質の行う相同対合,鎖交換反応の分子機構について考察を行っている. まず,本論文の第2章において,RecAタンパク質の単鎖DNA依存性ATPase活性を指標とし,RecAタンパク質の安定性に対する諸因子(NaCl,MgCl2等の塩濃度,グリセロール濃度,メルカプトエタノール,EDTA,緩衝剤等)の影響について検討を行い,RecAタンパク質を用いた長時間の測定には100mM程度のNaClあるいは5〜10%程度のグリセロールが有効であり,これらの条件下ではRecAタンパク質は少なくとも3日間は活性を維持することを報告している. 本論文の第3章においては,第2章で決定した溶媒条件を用い,短いDNAオリゴマー(3〜6残基)を利用したTRNOE法による立体構造解析について報告している.TRNOEスペクトルの測定により,RecAタンパク質に結合した状態でのDNAの構造情報を取得し,それに基づいた構造計算を施すことによって,RecAタンパク質に結合した単鎖DNAは新規のdeoxyribose-baseスタッキング相互作用により,通常のDNAに比べ引き伸ばされた構造を取っていることを初めて示した.また,このTRNOEシグナルは補助因子,基質に依存的であり,補助因子としてATP Sの代わりにADPを,あるいはDNAオリゴマーの代わりにRNAオリゴマーを用いるとシグナルが減少したことを報告している.さらに,緩和行列解析により,RecAタンパク質に結合した単鎖DNAはC2’-endoとC3’-endo,およびantiとsynの平衡状態にあることを示し,この構造の柔軟性が単鎖DNAと二重鎖DNAとの間の塩基対を交換するという動的な反応を可能にさせる要因となっていると考察している.また,第4章において,RecAタンパク質に結合した二重鎖DNAについてモデリングを行い,その結果から,相同組換え酵素による相同組換えの分子機構について考察を行い,特に糖パッカリングのN型からS型への変換に伴う塩基の回転によって塩基対の交換が行われると提唱している.これまで,相同組換え酵素に結合したDNAについては詳細な構造情報が得られていなかったが,今回のDNA構造の解明は,相同組換えの反応機構の分子構造レベルでの理解に対して,大きな貢献をすることが期待される. Sの代わりにADPを,あるいはDNAオリゴマーの代わりにRNAオリゴマーを用いるとシグナルが減少したことを報告している.さらに,緩和行列解析により,RecAタンパク質に結合した単鎖DNAはC2’-endoとC3’-endo,およびantiとsynの平衡状態にあることを示し,この構造の柔軟性が単鎖DNAと二重鎖DNAとの間の塩基対を交換するという動的な反応を可能にさせる要因となっていると考察している.また,第4章において,RecAタンパク質に結合した二重鎖DNAについてモデリングを行い,その結果から,相同組換え酵素による相同組換えの分子機構について考察を行い,特に糖パッカリングのN型からS型への変換に伴う塩基の回転によって塩基対の交換が行われると提唱している.これまで,相同組換え酵素に結合したDNAについては詳細な構造情報が得られていなかったが,今回のDNA構造の解明は,相同組換えの反応機構の分子構造レベルでの理解に対して,大きな貢献をすることが期待される. 以上の研究において,RecAタンパク質の精製,活性測定,DNAオリゴマーの合成および精製,サンプル調製,NMR測定,構造解析,モデリングなど,すべて論文提出者が主体となって行ったものであり,審査委員会は,本論文提出者が博士(理学)の学位を受ける資格があるものと判定する.なお,本論文は,東京大学大学院理学系研究科の横山 茂之教授および理化学研究所の柴田 武彦主任研究員,伊藤 隆研究員補との共同研究であるが,論文提出者が主体となって分析および検証を行ったもので,論文提出者の寄与が十分であると判断する. よって,博士(理学)の学位を授与できると認める. |