細胞骨格は様々な制御因子の作用により動的に変化し細胞分裂、細胞形態の形成や維持、細胞の運動、細胞接着など様々な生命現象を担っている。細胞骨格には大きく分けてマイクロフィラメント、微小管、中間径フィラメントの三つの細胞骨格系が存在する。このうちマイクロフィラメント系と微小管系はとりわけ動的な集合の再編成が起こる系として知られている。特にマイクロフィラメント系に関しては数多くのアクチン結合タンパク質がアクチンのダイナミックスに重要な役割を果たしていることが報告されている。 近年チューブリンにおいて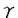 -チューブリンが発見されたのと同様に、アクチンにも類似性を示すいくつものアクチン関連蛋白質(Arps)が見いだされ、アクチンや以前から指摘のあったHSC70などとともにアクチンスーパーファミリーを形成していることが明らかにされた。現在のところArpsは分子量やアミノ酸配列の特徴からArp1からArp6のクラスに分けられている。全てのクラスにおいて二価カチオンとヌクレオチドの結合ボケット(サブドメイン1/3)はよく保存されている。分子の基本的な立体構造はアクチンと類似していると推測されているもののアクチン-アクチン相互作用、ミオシンやその他のアクチン結合タンパク質との相互作用を担うと考えられるループ部分の保存性はそれぞれのクラスによりアクチンとの相同性は異なり、各クラスの蛋白質の細胞内での機能はそれぞれ異なると考えられている。そのうちArp1は最初にヒトでdynactin complex構成成分(actinRPV)として報告され、またイヌでは中心体に濃縮する蛋白質(centractin)として見いだされた。 -チューブリンが発見されたのと同様に、アクチンにも類似性を示すいくつものアクチン関連蛋白質(Arps)が見いだされ、アクチンや以前から指摘のあったHSC70などとともにアクチンスーパーファミリーを形成していることが明らかにされた。現在のところArpsは分子量やアミノ酸配列の特徴からArp1からArp6のクラスに分けられている。全てのクラスにおいて二価カチオンとヌクレオチドの結合ボケット(サブドメイン1/3)はよく保存されている。分子の基本的な立体構造はアクチンと類似していると推測されているもののアクチン-アクチン相互作用、ミオシンやその他のアクチン結合タンパク質との相互作用を担うと考えられるループ部分の保存性はそれぞれのクラスによりアクチンとの相同性は異なり、各クラスの蛋白質の細胞内での機能はそれぞれ異なると考えられている。そのうちArp1は最初にヒトでdynactin complex構成成分(actinRPV)として報告され、またイヌでは中心体に濃縮する蛋白質(centractin)として見いだされた。 このdynactin complexは微小管の逆走モーター蛋白質であり細胞内でのオルガネラの輸送に深く関与している細胞質dyneinの活性化因子として見いだされた。dynactin complexはp160/150、p62、p50、p45、p37、p32、p27、p24のサブユニットからなる高次複合体で沈降係数は20Sである。それぞれのサブユニットの構成比は2:1:5:10:1:1:1:1とされている。そのうちp160/150のdynactinsはすでにcDNAがクローニングされており、ショウジョウバエの必須遺伝子であるGlued遺伝子の遺伝子産物やラットのdynein-binding protein(150kDa)のホモログであることが報告されている。また p45はアクチンと Arp1 であること、dynactin complexに存在しているp45のほとんどがArp1でありアクチンはごく微量であることが示されている。さらにp37とp32はF-アクチンの反矢尻端結合蛋白質のCapZ( 1- 1- 2/ 2/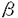 2)であることが明らかになっている。dynactin complexの分子形態についてはロータリーシャドウイング法を用いた電子顕微鏡による観察で幅が約10nmで長さが約37nmのらせん形のフィラメント状構造とその側面から出ていて先端に二つのglobular headを持った長さ24.3±2.2nmのフィラメント状の突起によって構成されていることが報告された。多くの場合この突起はフィラメント状構造のどちらか一方の末端付近に局在している。このらせん形のフィラメント状構造についてはアクチンフィラメントと幅やらせんの周期が類似しており「Arp1-filam ent」であると推測されている。さらにCapZはArp1-filamentの末端に結合し、一方p62はArp1-filamentのCapZが結合していない反対側の末端に結合しているのではないかと推測されている。また、突起については主にdynactin(p160/150)によって構成されていることがわかっている。p50についてはdynactin complexをKIで処理した後もdynactin(p160/150)と強固に結合していることからp50とdynactin(p160/150)は直接結合していると考えられている。残りの二つのサブユニットであるp27とp24については今のところ報告がない。 2)であることが明らかになっている。dynactin complexの分子形態についてはロータリーシャドウイング法を用いた電子顕微鏡による観察で幅が約10nmで長さが約37nmのらせん形のフィラメント状構造とその側面から出ていて先端に二つのglobular headを持った長さ24.3±2.2nmのフィラメント状の突起によって構成されていることが報告された。多くの場合この突起はフィラメント状構造のどちらか一方の末端付近に局在している。このらせん形のフィラメント状構造についてはアクチンフィラメントと幅やらせんの周期が類似しており「Arp1-filam ent」であると推測されている。さらにCapZはArp1-filamentの末端に結合し、一方p62はArp1-filamentのCapZが結合していない反対側の末端に結合しているのではないかと推測されている。また、突起については主にdynactin(p160/150)によって構成されていることがわかっている。p50についてはdynactin complexをKIで処理した後もdynactin(p160/150)と強固に結合していることからp50とdynactin(p160/150)は直接結合していると考えられている。残りの二つのサブユニットであるp27とp24については今のところ報告がない。 またアクチンやチューブリンのシャベロニンであるTCP-1complexを用いたin vitroでの実験ではArp1はATPと結合し、単独では重合できないがアクチン存在下では共重合するという。このようにArp1は微小管系細胞骨格と相互作用し、また細胞内でのアクチンとの相互作用についても注目されるが、アクチンとの相互作用に関する報告は皆無である。 本研究では微小管系細胞骨格との相互作用が報告され、またin vitroでのアクチンとの共重合が報告されているArp1に着目し、アクチンとの相互作用について視野に入れ、細胞内でのArp1の機能について検討することを目的とした。研究を進める上で、数多くの細胞株が樹立されているマウスを実験材料として用いることとした。そこで、第一部ではまずマウスArp1のcDNAクローニングとその遺伝子発現について検討した。まずArp1のcDNAを得るためにイヌ -Arp1およびヒト -Arp1およびヒト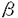 -Arp1のcDNA配列をもとにプライマーを作製し -Arp1のcDNA配列をもとにプライマーを作製し -Arp1についてはマウス横隔膜のcDNAライブラリーを、 -Arp1についてはマウス横隔膜のcDNAライブラリーを、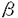 -Arp1についてはマウス脳のtotal RNAをテンプレートとしてPCRを行った。その結果、マウスの -Arp1についてはマウス脳のtotal RNAをテンプレートとしてPCRを行った。その結果、マウスの -Arp1および -Arp1および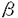 -Arp1にそれぞれ対応すると思われるcDNA断片を得た。このcDNA断片はアミノ酸翻訳領域を全て含んでいると考えられたので相互のホモロジーを検討したところ91.0%の相同性を示した(図1)。また、他の動物間とのホモロジーについても検討したところ -Arp1にそれぞれ対応すると思われるcDNA断片を得た。このcDNA断片はアミノ酸翻訳領域を全て含んでいると考えられたので相互のホモロジーを検討したところ91.0%の相同性を示した(図1)。また、他の動物間とのホモロジーについても検討したところ -Arp1についてはヒトおよびイヌのアミノ酸配列と完全に同一であり、 -Arp1についてはヒトおよびイヌのアミノ酸配列と完全に同一であり、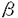 -Arp1についてはヒトの -Arp1についてはヒトの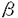 -Arp1と98.7%の相同性を示した(図1)。さらに -Arp1と98.7%の相同性を示した(図1)。さらに -Arp1についてはこのcDNA断片をプローブとしてマウス横隔膜のcDNAライブラリーより全長のcDNAをクローニングした。その結果、二種類のcDNAが得られ、その塩基配列の違いは3’側のアミノ酸非翻訳領域での1.3kbの長い挿入配列の有無であった。マウスのゲノムDNAを用いたサザンプロットの結果と考えあわせると、この両者は単一遺伝子に由来しオルタネイティヴスプライシングにより生じたものと考えられる。 -Arp1についてはこのcDNA断片をプローブとしてマウス横隔膜のcDNAライブラリーより全長のcDNAをクローニングした。その結果、二種類のcDNAが得られ、その塩基配列の違いは3’側のアミノ酸非翻訳領域での1.3kbの長い挿入配列の有無であった。マウスのゲノムDNAを用いたサザンプロットの結果と考えあわせると、この両者は単一遺伝子に由来しオルタネイティヴスプライシングにより生じたものと考えられる。 次にマウスの組織における -Arp1、 -Arp1、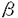 -Arp1の両mRNAの発現様式について検討したところ、両者とも検討したすべての組織で発現が見られ、脳では他の組織に比べ高い発現が見られた。また、 -Arp1の両mRNAの発現様式について検討したところ、両者とも検討したすべての組織で発現が見られ、脳では他の組織に比べ高い発現が見られた。また、 -Arp1に関してはすべての組織に発現している2.8kbのmRNAとは別に骨格筋に特異的な1.5kbのmRNAが検出された。ここで1.3kbの挿入配列の無いタイプのcDNAはこの1.5kbのmRNAと長さがほぼ一致することからこのmRNAに由来するものであり骨格筋特異的に発現しているのは1.3kbの挿入配列の無いタイプであることが示唆された。さらにこのmRNAの骨格筋での発現を細胞分化と対比させてより詳細に検討する目的でマウス骨格筋由来の株細胞を用いて解析したところ、筋芽細胞がら筋管細胞へと分化し成熟すると1.5kbのmRNAが発現することが分かった。 -Arp1に関してはすべての組織に発現している2.8kbのmRNAとは別に骨格筋に特異的な1.5kbのmRNAが検出された。ここで1.3kbの挿入配列の無いタイプのcDNAはこの1.5kbのmRNAと長さがほぼ一致することからこのmRNAに由来するものであり骨格筋特異的に発現しているのは1.3kbの挿入配列の無いタイプであることが示唆された。さらにこのmRNAの骨格筋での発現を細胞分化と対比させてより詳細に検討する目的でマウス骨格筋由来の株細胞を用いて解析したところ、筋芽細胞がら筋管細胞へと分化し成熟すると1.5kbのmRNAが発現することが分かった。  図1マウスの 図1マウスの -Arp1及び -Arp1及び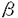 -Arp1とヒトの -Arp1とヒトの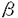 -Arp1との一次構造の比較。それぞれMouse -Arp1との一次構造の比較。それぞれMouse :マウスの :マウスの -Arp1、Mouse -Arp1、Mouse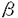 :マウスの :マウスの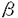 -Arp1、Human -Arp1、Human  :ヒトの :ヒトの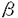 -Arp1のアミノ酸配列を示す。マウスの -Arp1のアミノ酸配列を示す。マウスの -Arp1のアミノ酸配列と同一のアミノ酸はdouble dotで示す。 -Arp1のアミノ酸配列と同一のアミノ酸はdouble dotで示す。 第二部では細胞内でのArp1の機能及び局在について解析した。まず今回得られた -Arp1のcDNAをトランスフェクション法により培養細胞に導入して過剰に発現させることにより細胞内でどのような影響を及ぼすかについて検討した。 -Arp1のcDNAをトランスフェクション法により培養細胞に導入して過剰に発現させることにより細胞内でどのような影響を及ぼすかについて検討した。 -Arp1のcDNAを培養細胞に導入するに際し、 -Arp1のcDNAを培養細胞に導入するに際し、 -Arp1のN-末端にヒトのc-myc蛋白質のエビトーブタグ(myc-タグ)を付加するようにcDNAを改変して(myc- -Arp1のN-末端にヒトのc-myc蛋白質のエビトーブタグ(myc-タグ)を付加するようにcDNAを改変して(myc- -Arp1)、ベクターを構築した。このベクターをマウス繊維芽細胞由来の細胞株であるNIH3T3細胞に導入し、抗myc-タグ抗体を用いて蛍光抗体法で観察したところ、細胞質内に細かいドット状の構造や、バンドル状の構造を形成している細胞が見いだされた。そこで次にこれらの構造とマイクロフィラメント系や微小管系との局在を比較するために抗myc-タグ抗体の抗チューブリン抗体や抗アクチン抗体との二重染色を行った。その結果、特に分裂期の細胞においてドット状の構造の微小管形成中心(MTOC)領域への濃縮が見られた。このことはArp1が中心体に濃縮するという報告と合致するもので、導入したmyc- -Arp1)、ベクターを構築した。このベクターをマウス繊維芽細胞由来の細胞株であるNIH3T3細胞に導入し、抗myc-タグ抗体を用いて蛍光抗体法で観察したところ、細胞質内に細かいドット状の構造や、バンドル状の構造を形成している細胞が見いだされた。そこで次にこれらの構造とマイクロフィラメント系や微小管系との局在を比較するために抗myc-タグ抗体の抗チューブリン抗体や抗アクチン抗体との二重染色を行った。その結果、特に分裂期の細胞においてドット状の構造の微小管形成中心(MTOC)領域への濃縮が見られた。このことはArp1が中心体に濃縮するという報告と合致するもので、導入したmyc- -Arp1がdynactin complexの構成因子として取り込まれている可能性が考えられる。一方、バンドル状の構造については抗アクチン抗体による染色は認められなかったことからこの構造は主にmyc- -Arp1がdynactin complexの構成因子として取り込まれている可能性が考えられる。一方、バンドル状の構造については抗アクチン抗体による染色は認められなかったことからこの構造は主にmyc- -Arp1によって形成されておりアクチンは含まれないか極めて微量であることが示唆された。 -Arp1によって形成されておりアクチンは含まれないか極めて微量であることが示唆された。 ここで、アクチンは細胞を薬剤処理(DMSOやNaCl溶液)や熱処理によりストレス条件に置くとアクチンロッドと呼ばれる構造を形成することが知られている。そこで今度はmyc- -Arp1を導入した細胞にDMSO処理またはNaCl溶液処理を行いアクチンロツドを誘導しその局在をアクチンと比較した。その結果DMSO処理またはNaCl溶液処理どちらの場合でもmyc- -Arp1を導入した細胞にDMSO処理またはNaCl溶液処理を行いアクチンロツドを誘導しその局在をアクチンと比較した。その結果DMSO処理またはNaCl溶液処理どちらの場合でもmyc- -Arp1とアクチンが共存するロッド構造が観察された。このことからArp1がin vitroだけでなくin vivoにおいてもアクチンと相互作用しうること示唆された。また過剰に発現させただけではアクチンとArp1が共存するロッド構造は観察されないことからArp1とアクチンの相互作用は厳密に制御されていることも考えられる。 -Arp1とアクチンが共存するロッド構造が観察された。このことからArp1がin vitroだけでなくin vivoにおいてもアクチンと相互作用しうること示唆された。また過剰に発現させただけではアクチンとArp1が共存するロッド構造は観察されないことからArp1とアクチンの相互作用は厳密に制御されていることも考えられる。 |