学位論文要旨
| No | 112496 | |
| 著者(漢字) | 道羅,英夫 | |
| 著者(英字) | Dohra,Hideo | |
| 著者(カナ) | ドウラ,ヒデオ | |
| 標題(和) | ゾウリムシ大核内共生細菌に関する分子細胞生物学的研究 | |
| 標題(洋) | Molecular and cellular biological studies on the macronucleus-specific symbiont Holospora Obtusa of the ciliate Paramecium Caudatum | |
| 報告番号 | 112496 | |
| 報告番号 | 甲12496 | |
| 学位授与日 | 1997.03.28 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(理学) | |
| 学位記番号 | 博理第3276号 | |
| 研究科 | 理学系研究科 | |
| 専攻 | 生物科学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | ゾウリムシParamecium caudatumの大核内共生細菌Holospora obtusaは宿主の栄養状態に応じて増殖型と感染型の2種類の形態を示す。増殖型は宿主が増殖している間は二分裂によって増殖するが、宿主が飢餓状態になると分裂をやめて伸長し、中間型を経て感染型へと分化する(図1)。増殖型と感染型は構造的、機能的に分化しており、タンパク質組成も異なっていることから、遺伝子発現についても異なっていることが予想される。そこで、H.obtusaの増殖型と感染型の違いを遺伝子発現のレベルで明らかにすることを目的として、増殖型には存在せず、中間型と感染型に存在する分子量5.4kDaのペプチドと、増殖型に多量に存在するGroELホモログの解析を行った。 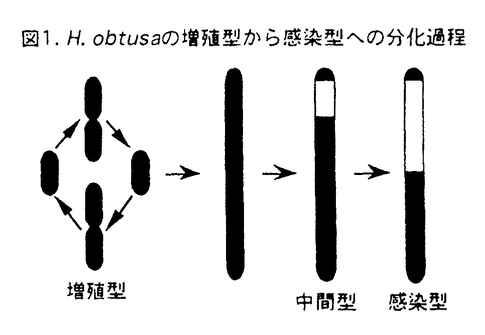 5.4kDaペプチドをNative-PAGEおよび逆相クロマトグラフィーにより精製し、N末端のアミノ酸配列とペプチダーゼで切断した断片のアミノ酸配列を決定した。それらから推測されるヌクレオチド配列をプライマーとしてPCRを行い、このペプチドをコードする遺伝子の部分的な塩基配列を決定した。さらにその上流、下流の領域をカセットPCRにより増幅し、遺伝子の全塩基配列を決定した。その配列の解析から、このペプチドは49個のアミノ酸から構成され、計算上の分子量は5,434であることが明らかになった。また、このペプチドの上流にはシグナルペプチドと思われる19個のアミノ酸がコードされていることも明らかになった。ノーザンブロットハイブリダイゼーションによりこの遺伝子の発現を増殖型、中間型、感染型で比較した結果、増殖型では発現しておらず、中間型で最も多量に発現し、感染型への分化が進むにつれて発現量は減少した。抗5.4kDaペプチド抗血清を用いた免疫電子顕微鏡観察により、このペプチドは感染型のペリプラズムに局在していることが明らかになった。現在のところ、このペプチドに相同性のある既知のペプチドは見つかっておらず、その機能は明らかではないが、このペプチドを発現させた大腸菌は分裂を停止することから、増殖型から感染型へ分化する際の分裂の停止に関与している可能性が示唆された。 GroELホモログは真正細菌や真核細胞のオルガネラに普遍的に存在する熱ショックタンパク質の一種である。アブラムシの共生細菌や根粒菌、結核菌、クラミジア、リケッチアなどの細胞内寄生性細菌は宿主内でこのタンパク質を多量に合成していることが知られている。H.obtusaの増殖型と感染型でGroELホモログの合成パターンを比較した結果、増殖型は宿主大核内ではGroELホモログを選択的に合成していたが、単離してin vitroで培養すると他のタンパク質も合成するようになった。一方、感染型は宿主大核内でもin vitroでもこのタンパクを少量しか合成しなかった。GroELはストレスタンパク質なので、この結果は、増殖型は宿主大核内ではストレス条件下にあり、感染型はストレスから開放された状態にあることを示唆している。また、GroELホモログは熱ショックタンパク質なので、単離した増殖型と感染型が熱ショック条件下で合成するGroELホモログの量の変化についても調べた。増殖型では培養温度を25℃から33℃に上げてもタンパク質合成のパターンは変化しなかったが、36℃にするとGroELホモログの合成量は増加し、39℃以上では低下した。このとき、他の熱ショックタンパク質の合成も同様の変動を示した。一方、感染型では培養温度を上げるにつれて徐々にGroELホモログの合成量が増加し、36℃で最大に達し、39℃以上になると低下した。このように、宿主大核内で選択的にGroELホモログを合成している増殖型でも少量しか合成していない感染型でもin vitroでの熱ショックによってGroELホモログの合成が誘導された。また、宿主大核内ではあまり合成されていないGroELホモログ以外の熱ショックタンパク質の合成も誘導された。これらの結果はin vitroでの熱ショック応答は宿主大核内でのH.obtusaのストレス応答とは異なる機構で起こっていることを示唆している。次に、増殖型のストレス要因となっている物質が宿主大核内に存在するかどうかを調べるために、宿主の大核抽出物の存在下で単離した増殖型と感染型のタンパク質合成のパターンを調べた結果、どちらの形態でもGroELホモログの合成は誘導されず、全体的にタンパク質合成は抑制された。一方、コントロールとして用いたゾウリムシの餌のバクテリアであるKlebsiella pneumoniaeでは、大核抽出物の添加によってタンパク質合成が促進された。共生細菌のH.obtusaと自由生活性の細菌K.pneumoniaeで同じ大核抽出物に対する応答が異なるのは興味深い。ゾウリムシはH.obtusaのタンパク質合成を阻害することによってその過剰な分裂を抑制し、共生関係が破綻するのを防いでいるのかも知れない。 H.obtusaのGroELホモログの性質を調べるために、5.4kDaペプチドの場合と同様の方法により、その遺伝子をクローニングし、塩基配列を決定した。その配列を解析した結果、H.obtusaのGroELホモログは554個のアミノ酸で構成されており、大腸菌のGroELと55.2%の配列同一性を示した。また、groEL遺伝子はその上流に存在するgroES遺伝子と単一のオペロンを形成していた。GroESホモログは96個のアミノ酸から構成されており、大腸菌のGroESと39.6%の同一性を示した。ノーザンブロットハイブリダイゼーションにより、groEL遺伝子の発現量を増殖型、中間型、感染型で比較した結果、増殖型で非常に多量に発現し、中間型と感染型ではごくわずかにしか発現しておらず、感染型への分化が進むにつれて発現量が低下することが示された。この形態によるgroEL遺伝子の発現量の違いがどのようなメカニズムによって調節されているのかはまだ明らかではない。一つの可能性としては、対数増殖期のゾウリムシの大核内にはH.obtusaのストレス要因となる物質が含まれていて、その時期に宿主大核内にいる増殖型はgroEL遺伝子を多量に発現しているが、感染型をもつ定常期のゾウリムシの大核内にはそのストレス因子がなくなっていることが考えられる。もう一つの可能性としては、増殖型が感染型に分化する過程で大核内のストレス因子に対して抵抗性を獲得するような変化が生じるということがあげられる。感染型は細胞質を取り囲む巨大なペリプラズムと丈夫な細胞壁をもっており、これらが原因となって大核内ストレスに対する応答を示さないのかも知れない。GroELに対する抗血清を用いた免疫電子顕微鏡観察から、H.obtusaのGroELホモログは増殖型と感染型の細胞質に局在することが示された。 H.obtusaと他のバクテリアとの進化的な系統関係を調べるために、GroELホモログのアミノ酸配列をもとにして系統樹を作製した。その結果、H.obtusaはProteobacteriaの 本研究では、H.obtusaの2種類の形態にそれぞれ特徴的なタンパク質の遺伝子発現を調べることを通じて、増殖型と感染型の遺伝子発現における質的および量的な違いを明らかにした。これらの遺伝子発現の調節機構はまだ明らかではないが、それを調べることによって、H.obtusaの形態特異的な遺伝子発現の調節機構の解明、さらにはそれを制御していると想像される共生体・宿主間の相互作用への理解が進むものと期待される。 | |
| 審査要旨 | 本論文は2章から成り、第1章はゾウリムシParamecium caudatumの大核内共生細菌Holospora obtusaの増殖型には存在せず、中間型と感染型に存在する分子量5.4kDaのペプチドの解析について述べられている。第2章は増殖型に多量に存在するGroELホモログの解析について述べられている。 H.obtusaは宿主の栄養状態に応じて増殖型と感染型の2種類の形態を示す。増殖型は宿主が増殖している間は二分裂によって増殖するが、宿主が飢餓状態になると分裂をやめて伸長し、中間型を経て感染型へと分化する。増殖型と感染型は構造的、機能的に分化しており、タンパク質組成も異なっていることから、遺伝子発現についても異なっていることが予想される。そこで、本論文では、H.obtusaの増殖型と感染型の違いを遺伝子発現のレベルで明らかにすることを目的として、増殖型には存在せず、中間型と感染型に存在する分子量5.4kDaのペプチドと、増殖型に多量に存在するGroELホモログの解析を行っている。 精製した5.4kDaペプチドのアミノ酸配列を決定し、それから推測されるヌクレオチド配列をプライマーとしてPCRを行い、このペプチドをコードする遺伝子の全塩基配列を決定した。その配列を解析することにより、このペプチドは49個のアミノ酸から構成され、計算上の分子量は5,434であることを明らかにした。また、このペプチドの上流にはシグナルペプチドと思われる19個のアミノ酸がコードされていることも明らかにした。ノーザンブロットハイブリダイゼーションでこの遺伝子の発現を増殖型、中間型、感染型で比較することにより、5.4kDaペプチド遺伝子は増殖型では発現しておらず、中間型で最も多量に発現し、感染型への分化が進むにつれて発現量は減少することを示した。また、抗5.4kDaペプチド抗血清を用いた免疫電子顕微鏡観察により、このペプチドは感染型のペリプラズムに局在していることを明らかにした。 H.obtusaの増殖型と感染型でGroELホモログの合成を比較することにより、増殖型は宿主大核内ではストレスタンパク質であるGroELホモログを選択的に合成しているが、単離してin vitroで培養すると他のタンパク質も合成するようになること、一方、感染型は宿主大核内でもin vitroでもこのタンパク質を少量しか合成しないことを示した。これにより、増殖型は宿主大核内ではストレス条件下にあり、感染型はストレスから開放された状態にあることが示唆された。単離した増殖型と感染型が熱ショック条件下で合成するGroELホモログの量の変化について調べることにより、増殖型と感染型は熱ショックによってGroELホモログの合成が誘導されること、宿主大核内ではあまり合成されていないGroELホモログ以外の熱ショックタンパク質の合成も誘導されることを明らかにした。これらの結果により、in vitroでの熱ショック応答は宿主大核内でのH.obtusaのストレス応答とは異なる機構で起こっていることが示唆された。また、GroELに対する抗体を用いたイムノブロットにより、増殖型から感染型への分化過程において、細胞あたりのGroELホモログの量はほとんど変化しないことを示した。 H.obtusaのGroELホモログの性質をさらに調べるために、その遺伝子のクローニング、および全塩基配列の決定を行っている。その配列を解析することにより、H.obtusaのGroELホモログは554個のアミノ酸で構成されており、大腸菌のGroELと55.2%の配列同一性を示すことを明らかにした。また、groEL遺伝子はその上流に存在するgroES遺伝子と単一のオペロンを形成していること、そしてその遺伝子にコードされているGroESホモログは96個のアミノ酸から構成されており、大腸菌のGroESと39.6%の同一性を示すことも明らかにした。ノーザンブロットハイブリダイゼーションでgroEL遺伝子の発現量を増殖型、中間型、感染型で比較することにより、groEL遺伝子は増殖型で非常に多量に発現し、中間型と感染型ではごくわずかにしか発現しておらず、感染型への分化が進むにつれて発現量が低下することを示した。また、GroELに対する抗血清を用いた免疫電子顕微鏡観察により、H.obtusaのGroELホモログは増殖型と感染型の細胞質に局在することを示した。 なお、本論文第1章は山本一夫氏、藤島政博氏、石川統氏との共同研究、第2章は藤島政博氏、石川統氏との共同研究であるが、論文提出者が主体となって実験を行ったもので、論文提出者の寄与が十分であると判断した。 よって、博士(理学)の学位を授与できると認めた。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54567 |
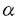 -subdivisionに属し、Rickettsia,Ehrlichia,Cowdriaなどの細胞内寄生性細菌に近縁であることが示された。Rickettsiaのなかには細胞質内ばかりでなく、核内でも増殖できる種が報告されており、H.obtusaの共生の起源を考える上で非常に興味深い。同じ原生動物の細胞内共生細菌の中で、系統関係が明らかになっているものに肉質虫類のアメーバと共生しているX-バクテリアがある。このバクテリアはProteobacteriaの
-subdivisionに属し、Rickettsia,Ehrlichia,Cowdriaなどの細胞内寄生性細菌に近縁であることが示された。Rickettsiaのなかには細胞質内ばかりでなく、核内でも増殖できる種が報告されており、H.obtusaの共生の起源を考える上で非常に興味深い。同じ原生動物の細胞内共生細菌の中で、系統関係が明らかになっているものに肉質虫類のアメーバと共生しているX-バクテリアがある。このバクテリアはProteobacteriaの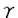 -subdivisionに属し、H.obtusaとは系統的に離れており、原生動物における共生現象の多様性を物語っている。
-subdivisionに属し、H.obtusaとは系統的に離れており、原生動物における共生現象の多様性を物語っている。