本論文は分裂酵母のおけるイノシトールリン脂質特異的なホスフォリパーゼCの機能について分子遺伝学的に解析したものである。リン脂質代謝と紫外線感受性の関連を初めて明らかにしたことは高く評価される。各章の詳細は以下のとおりである。
序論 哺乳動物細胞のイノシトールリン脂質特異的ホスフォリパーゼC(PLC)には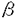 、
、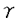 、
、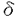 という構造上異なる3種のタイプが存在することが知られており、
という構造上異なる3種のタイプが存在することが知られており、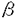 タイプは三量体G蛋白質によって、また受容体結合型である
タイプは三量体G蛋白質によって、また受容体結合型である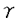 タイプはチロシン残基のリン酸化によって、各々活性化されることが報告されている。一方、
タイプはチロシン残基のリン酸化によって、各々活性化されることが報告されている。一方、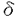 タイプについては、最近になってrho-GAPがPLC-
タイプについては、最近になってrho-GAPがPLC-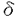 1に結合し活性化に関わるという報告やPLC-
1に結合し活性化に関わるという報告やPLC-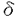 4が増殖刺激後の細胞内で核中に集積するという報告がなされている。これらの報告は、PLC-
4が増殖刺激後の細胞内で核中に集積するという報告がなされている。これらの報告は、PLC-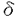 がPLC-
がPLC-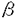 、
、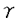 と同様に何らかの情報伝達系を構成することや核内で重要な役割を担っていることを示唆するものであるが、現在のところPLC-
と同様に何らかの情報伝達系を構成することや核内で重要な役割を担っていることを示唆するものであるが、現在のところPLC-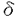 を介した情報伝達系上の因子のほとんどは不明でありその意義に関しても明らかになっていない。
を介した情報伝達系上の因子のほとんどは不明でありその意義に関しても明らかになっていない。
分裂酵母および出芽酵母はともにPLCをコードする唯一の遺伝子(PLC1およびplc1+)を持っており、これらはPLC-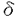 1に最も相同性の高い蛋白質をコードする。分裂酵母のplc1遺伝子破壊株が低pH培地および高アンモニウム培地で生育不能であることや出芽酵母のplc1遺伝子破壊株が高糖濃度培地で生育不能であることから、PLCは酵母が外界の栄養源やストレスに応答する際に必要であると考えられる。私は、分裂酵母を材料に、PLCを介した情報伝達系上の未知の因子を探索しその意義を検討する目的で、two-hybrid法、免疫学的手法、および遺伝学的手法を用いて解析を行なった。この結果、14-3-3蛋白質がPLCを介した情報伝達系に関わっていること、およびPLCと14-3-3蛋白質とが同一の経路で細胞の紫外線防御に寄与していることを明らかにした。
1に最も相同性の高い蛋白質をコードする。分裂酵母のplc1遺伝子破壊株が低pH培地および高アンモニウム培地で生育不能であることや出芽酵母のplc1遺伝子破壊株が高糖濃度培地で生育不能であることから、PLCは酵母が外界の栄養源やストレスに応答する際に必要であると考えられる。私は、分裂酵母を材料に、PLCを介した情報伝達系上の未知の因子を探索しその意義を検討する目的で、two-hybrid法、免疫学的手法、および遺伝学的手法を用いて解析を行なった。この結果、14-3-3蛋白質がPLCを介した情報伝達系に関わっていること、およびPLCと14-3-3蛋白質とが同一の経路で細胞の紫外線防御に寄与していることを明らかにした。
第1章plc1+遺伝子に関する遺伝学的解析 plc1+遺伝子がPLCをコードすることを、plc1+高発現株からの細胞抽出液中のPLC活性を測定することにより確認した。また、plc1破壊株ではIP3量が野生型より著しく減少していることをあきらかにし、IP3の形成にPLCが重要な働きを果たしていることを示した。plc1破壊株が合成培地で生育できないために遺伝学的な方法の適用が制限されているので、新たにplc1突然変異体を分離することを試みた。幾つかの方法を試みたが、目的とする変異体は得られなかった。
第2章PLCと14-3-3蛋白質との物理的遺伝的相互作用 PLCを制御する因子あるいはPLCの下流で信号を受け取る因子を探索する目的で、Plc1pと結合する蛋白質をtwo-hybrid法により検索した。Plc1pとの結合活性をもつ4つの陽性クローンのうち2つはRad24pを、残りの2つはRad25pをコードしていた。Rad24pおよびRad25pは互いに71%の相同性をもつ14-3-3蛋白質であることが報告されている。哺乳動物細胞の14-3-3蛋白質は、情報伝達系の様々な因子と結合することが報告されており、MAPキナーゼ系への関与などが示唆されている。
Plc1pと14-3-3蛋白質との結合をさらに確認するために、免疫沈降実験を行なった。mycタグのついたPlc1p(myc-Plc1p)を過剰発現させたS.pombeの細胞破砕液に、大腸菌で発現させ精製したGST-Rad24p蛋白質を混合し、混合液にGSHビーズを加えて免疫沈降を行なったところ、免疫沈降物中にmyc-Plc1pが検出された。また、myc-Plc1pを過剰発現させたS.pombeの細胞破砕液に抗Rad24p抗体を加えて免疫沈降を行なうとmyc-Plc1pが、抗myc抗体を加えて免疫沈降を行なうとRad24pが、それぞれ検出された。これらの結果から、細胞内でPlc1pとRad24pとが複合体を形成することが示唆された。
rad24遺伝子破壊株は紫外線感受性を示すことが報告されており、その紫外線感受性を多コピーで抑圧する遺伝子としてrad25+遺伝子が単離されている。しかし、rad25遺伝子破壊株が野生型株と同程度の感受性を示すことから、紫外線耐性に関しては主にRad24pの役割が重要であると考えられる。Plc1pとRad24pとの結合は、Plc1pがRad24pとともに紫外線耐性に働いている可能性を示す。plc1遺伝子破壊株の紫外線感受性を調べたところ、rad24遺伝子破壊株と同様に紫外線感受性を示した。さらに、plc1 rad13二重遺伝子破壊株やrad24 rad13二重遺伝子破壊株が各々の単独の遺伝子破壊株と比べ強い感受性を示したのに対し、plc1 rad24二重遺伝子破壊株の紫外線感受性は、plc1遺伝子破壊株およびrad24遺伝子破壊株と同程度のものであった。従って、plc1+およびrad24+は紫外線感受性に関して同一の系に属すると考えられる。
rad24+遺伝子が分裂酵母のDNA損傷のチェックポイントに必要であるという報告があるが、rad24の遺伝子破壊株の表現型は他のチェックポイント変異株のそれに比べ、非常に弱い。Plc1pがDNA損傷のチェックポイントに働いているかどうかを調べるために、紫外線(75J/m2)照射後の細胞のM期への移行の様子を時間を追って追跡した。対数増殖期にある細胞を完全培地上に置き、30度で培養しながら15分おきに光学顕微鏡下で観察し、新たに隔膜を形成した細胞を計数した。150-200個の細胞を追跡することで、野生型株とrad3変異株とのチェックポイント機構の違いを検出することができた。野生型株では50%の細胞が隔膜を形成し終えるまでに、紫外線照射の有無によって31分の差が生まれたが、plc1遺伝子破壊株ではその差は33分であった。従って、plc1遺伝子破壊株のチェックポイント機構は正常であることが明らかとなった。さらに、rad24遺伝子破壊株ではその差は28分であり、野生型株に比べやや短いものの、rad3変異株とは明らかに異なる表現型を示した。これらの結果から、Plc1pとRad24pとがDNA損傷のチェックポイント以外の同一の紫外線防御経路で働いていることが強く示唆された。
それでは一体Plc1pはどのようにして紫外線防御に寄与しているのだろうか。哺乳動物細胞の系では、紫外線照射後に、RasやRaf、およびMAPキナーゼ系が活性化されることが知られており、その活性化はDNA損傷に依存しないことが示唆されている。紫外線によってAP-1転写因子を介して誘導される遺伝子の中には、紫外線照射後細胞内に生じるフリーラジカルを減じる役割を持つものも報告されており、この系がDNA損傷というよりはむしろフリーラジカルに対して防御機能をもつ可能性が指摘されている。分裂酵母においても、MAPキナーゼをコードするphh1+遺伝子を破壊した株が紫外線感受性を示すことが報告されているが、phh1遺伝子破壊株のチェックポイント機構は正常であった。さらに、plc1 phh1二重遺伝子破壊株の紫外線感受性を調べたところ、単独の遺伝子破壊株と同程度であった。これらの結果は、plc1+およびphh1+が同一の系で紫外線防御に働いていることを示唆すると同時に、分裂酵母が哺乳動物細胞と同様な紫外線防御機構を保持している可能性を示している。
two-hybrid法による解析から、14-3-3蛋白質はPlc1pのC末端側の活性領域ではなくN末端側に結合することが示された。Plc1pの活性に対する14-3-3蛋白質の影響を調べるために、myc-Plc1pを高発現させた分裂酵母細胞の細胞破砕液を分画し、高速(90000g)遠心後の上清分画についてPLC活性を測定した。rad24遺伝子破壊株、野生型株、Rad24pを高発現させた株について、上清分画中のPLC活性に変化はみられなかった。抗myc抗体による上清分画からの免疫沈降物中のPLC活性についても同様の結果が得られた。これらの結果から、Rad24pはPlc1pの活性を直接制御しているのではないことが示唆された。さらに意外なことに、紫外線照射によるPlc1pの活性の変化も認められなかった。
第3章Plc1pの局在に対する14-3-3蛋白質の影響 PLC活性の測定のための細胞分画の過程で、興味深い現象が観察された。細胞内のRad24p量が増えるにしたがって、つまりrad24遺伝子破壊株、野生型株、Rad24pを高発現させた株の順に、myc-Plc1pが沈殿画分から上清画分へと移行することが明らかとなった。このことから、Rad24pはPlc1pの活性を直接制御しているのではなく、Plc1pの局在や立体構造を変化させることで間接的にPlc1pを介した情報伝達を制御している可能性が示唆された。
哺乳動物のPLC-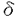 1の構造解析から、PLC-
1の構造解析から、PLC-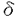 1がPHドメインを介して膜に結合し、さらに活性領域が膜に埋め込まれることで、膜に含まれるPIP2とPLC-
1がPHドメインを介して膜に結合し、さらに活性領域が膜に埋め込まれることで、膜に含まれるPIP2とPLC-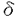 1の活性領域が接触し、PIP2の分解が起こるというモデルが提唱されている。Plc1pのN末端領域に14-3-3蛋白質が結合することから、Rad24pは、膜結合型のPlc1pの量を低レベルに保つ機能をもつことが考えられる。また、Plc1pと14-3-3蛋白質が紫外線防御に関して同方向に働くこと、および紫外線照射によるPlc1pの局在の変化がみられないことから、紫外線などのシグナルが来たときにRad24pが膜結合型のPlc1pの活性領域を膜に埋め込む段階に働いている可能性がある。
1の活性領域が接触し、PIP2の分解が起こるというモデルが提唱されている。Plc1pのN末端領域に14-3-3蛋白質が結合することから、Rad24pは、膜結合型のPlc1pの量を低レベルに保つ機能をもつことが考えられる。また、Plc1pと14-3-3蛋白質が紫外線防御に関して同方向に働くこと、および紫外線照射によるPlc1pの局在の変化がみられないことから、紫外線などのシグナルが来たときにRad24pが膜結合型のPlc1pの活性領域を膜に埋め込む段階に働いている可能性がある。
以上のように、学位申請者はPLCと相互作用する蛋白質として14-3-3を同定し、PLCが紫外線防御機構に必要であることを示した。また、PLCはMAPキナーゼを介して紫外線による刺激を細胞内に伝え障害からの回復に関わることを示した。発表論文は共著であるが、実験計画の策定およびその遂行は申請者によるものであり、審査員全員の一致により本論文が博士(理学)の学位に値するものであることが認められた。