| 内容要旨 | | <序> すべての真核細胞は,緻密に分化した膜構造すなわちオルガネラで構成されている.そのそれぞれのオルガネラに担われた役割を最高の効率で果たすためには,各オルガネラを構成するタンパク質が正しく選別されることが必須であり,そこではタンパク質のもつオルガネラ局在化シグナルとそれを認識する選別装置のはたらきがきわめて重要である.細胞外に分泌されるタンパク質は,シグナルペプチドの認識によってまず小胞体にターゲットされ,その後適切な修飾やプロセシングを受けながら小胞輸送によって,ゴルジ体,そして細胞膜へと輸送される.それでは,この途中に存在するオルガネラで機能するタンパク質は,どのような選別をうけているのだろうか?このうち,最初のステップである小胞体への局在化には,HDELやKKXXといったC末端のペプチド配列が局在化シグナルとして働くことが明らかとなってきたが,このようなシグナルを持たない小胞体タンパク質も多く存在し,いまだその局在化のメカニズムは謎に包まれている. 出芽酵母Saccharomyces cerevisiaeのSec12タンパク質(Sec12p)は,N末端側が細胞質側を向いたタイプII膜タンパク質で,小胞体からの輸送小胞の形成に必須な因子として同定された.このタンパク質は上述のような既知の小胞体局在化シグナルは持っていないが,定常状態においてその大部分は小胞体に局在しており,輸送小胞上にもほとんど検出されない.しかしながら,Sec12pは徐々にゴルジ体シス領域における糖鎖修飾を受けることから,このタンパク質の小胞体局在化には小胞体から出ないようにする静的残留機構とそれでも漏れ出てしまったものを小胞体に戻す動的逆送機構の両者がはたらいていると考えられる.西川は,これらの機構を解析するために,図1に示す手法を用いてSec12pと 接合因子(Mf 接合因子(Mf 1p)の融合タンパク質の局在が異常になるような2つの劣性変異株rer(return to the ER)を獲得した. 1p)の融合タンパク質の局在が異常になるような2つの劣性変異株rer(return to the ER)を獲得した. 本研究では,このうちRER1遺伝子産物に焦点をあて,その細胞内における局在,様々な膜タンパク質の小胞体局在化における役割を分子レベルで解明することを目指した.  図1.Sec12- 図1.Sec12- 複合因子前駆体融合タンパク質のプロセシング腫瘍.rer変異株ではSec12pの小亀体局在化に異常が生じ,この融合タンパク質はトランスゴルジ領域にまで輸送され,Kax2プロテアーゼによるプロセシングを受ける.その結果, 複合因子前駆体融合タンパク質のプロセシング腫瘍.rer変異株ではSec12pの小亀体局在化に異常が生じ,この融合タンパク質はトランスゴルジ領域にまで輸送され,Kax2プロテアーゼによるプロセシングを受ける.その結果, 接合因子前駆体部分から成熟型の 接合因子前駆体部分から成熟型の 接合因子が細胞外に分泌され,細胞のまわりにハローが形成される.<結果と考察>1)Rer1pの細胞内局在の決定 接合因子が細胞外に分泌され,細胞のまわりにハローが形成される.<結果と考察>1)Rer1pの細胞内局在の決定 修士課程において、rer1-2変異を相補する野生型遺伝子RER1のクローニングを試み,188アミノ酸からなる膜4回貫通タンパク質をコードする新規の遺伝子を同定した.そこでまず,この遺伝子産物について解析するために,Rer1pのC末端にHAエピトープを結合したタンパク質をコードする遺伝子(RER1-3HAを構築した.このRER1-3HAは,単コピーでrer1-2変異を相補した.そこで,このRER1-3HA遺伝子産物の細胞内局在を,間接蛍光抗体法によって解析したところ,小胞体や液胞は染色されず,酵母のゴルジ体の染色像に典型的なドット状のパターンが観察され,また,ゴルジ体に主に局在することが知られるYpt1pの染色像と2重染色においてほぼ一致した(図2).さらに,細胞分画法による解析からゴルジ体シス領域に局在するOch1pと同様の挙動を示すことが明らかとなった(図3).これらのことから,Rer1pは,シスゴルジ体膜に局在し,静的残留というよりもむしろSec12pをゴルジ体から小胞体へ戻す逆送過程に関与していると考えられた(Sato et al.,1995). 2)複数の膜タンパク質の小胞体局在化に共通に働く制限因子Rer1p 次に,Rer1pの機能の一般性を知るために,Sec12p以外の小胞体膜タンパク質についても解析を試みた.機能的にはたらくSec12p-Mf 1p融合タンパク質(S12Mp)に加えて,Sec12pとは正反対のトポロジーをとるSec71p,3回膜を貫通しているSec63pについて新たにMf 1p融合タンパク質(S12Mp)に加えて,Sec12pとは正反対のトポロジーをとるSec71p,3回膜を貫通しているSec63pについて新たにMf 1pとの融合タンパク質を構築し,それぞれMS71Hp,MS63Lpと名づけた(図4).Sec71pとSec63pはともに小胞体におけるタンパク質の膜透過に働く因子で,Sec12pと同様に上述のような既知の小胞体局在化シグナルは持っていない.構築したMS71Hp,MS63Lpは細胞内で十分に発現しており,定常状態において大部分が小胞体に局在していたことから,以後これらの融合タンパク質を細胞内モニターとして解析を行った.まず,野生株,rer1遺伝子破壊株におけるMS71HpあるいはMS63Lpの挙動をハローアッセイによって調べた(図5).驚いたことに,MS71Hp,MS63Lpともにrer1遺伝子破壊株において成熟型 1pとの融合タンパク質を構築し,それぞれMS71Hp,MS63Lpと名づけた(図4).Sec71pとSec63pはともに小胞体におけるタンパク質の膜透過に働く因子で,Sec12pと同様に上述のような既知の小胞体局在化シグナルは持っていない.構築したMS71Hp,MS63Lpは細胞内で十分に発現しており,定常状態において大部分が小胞体に局在していたことから,以後これらの融合タンパク質を細胞内モニターとして解析を行った.まず,野生株,rer1遺伝子破壊株におけるMS71HpあるいはMS63Lpの挙動をハローアッセイによって調べた(図5).驚いたことに,MS71Hp,MS63Lpともにrer1遺伝子破壊株において成熟型 接合因子の分泌によるハローを形成したことから,これらの小胞体局在にもまたRer1pが重要であることが明らかになった.一方,たとえ野生株であってもMS71Hp,MS63Lpを多コピープラスミド上で過剰発現したときは,ハローを形成した.このことから,これらのタンパク質の小胞体局在化の機構には量的な制限因子が存在し,それが飽和していると予想された. 接合因子の分泌によるハローを形成したことから,これらの小胞体局在にもまたRer1pが重要であることが明らかになった.一方,たとえ野生株であってもMS71Hp,MS63Lpを多コピープラスミド上で過剰発現したときは,ハローを形成した.このことから,これらのタンパク質の小胞体局在化の機構には量的な制限因子が存在し,それが飽和していると予想された. MS71Hpの過剰発現によってその一部がゴルジ体トランス領域まで輸送されてしまうことが明らかになったので,Rer1pがその制限因子である可能性について検証した.もし,Rer1pが制限因子であるならば,Rer1pの発現量も同時に増加させることによって,過剰分のMS71Hpによる成熟型 接合因子の分泌が抑制されると思われる.実際に,Rer1pは単コピープラスミド上で80%,多コピープラスミド上で50%にまで過剰なMS71Hpによって生じる成熟型 接合因子の分泌が抑制されると思われる.実際に,Rer1pは単コピープラスミド上で80%,多コピープラスミド上で50%にまで過剰なMS71Hpによって生じる成熟型 接合因子の分泌を抑制した(図6).このことから,Rer1pがMS71Hpの小胞体局在化における制限因子の一つであることが示唆された.一方,液胞膜タンパク質Dap2pとMf 接合因子の分泌を抑制した(図6).このことから,Rer1pがMS71Hpの小胞体局在化における制限因子の一つであることが示唆された.一方,液胞膜タンパク質Dap2pとMf 1pの融合タンパク質DDDmに対してはむしろ成熟型 1pの融合タンパク質DDDmに対してはむしろ成熟型 接合因子の分泌を促進する傾向が見られたことから,Rer1pは液胞への正方向輸送にもなんらかの影響を与えている可能性がある. 接合因子の分泌を促進する傾向が見られたことから,Rer1pは液胞への正方向輸送にもなんらかの影響を与えている可能性がある. さらに,Rer1pがSec12p,Sec71pのようなまったく正反対のトポロジーをとるものに対して共通の制限因子であるという可能性について検証した.もし,Sec12p,Sec71pが共通の因子によって認識されているならば,MS71HpだけでなくさらにSec71pそのものやSec12pの発現も同時に増加させることによって競争がおこり,結果としてMS71Hpから生じる成熟型 接合因子量は増加すると予想される.Sec12pの細胞質領域はRer1p非依存的な静的残留,膜貫通領域はRer1p依存的な逆送シグナルを含むことが明らかとなった(Sato et al.,1996)ので,Sec12pのかわりにDap2pそのもの(DDD)と,膜貫通領域をSec12pのものと置換し完全に小胞体に局在化するようになったキメラ(DSD)を用いて解析を行った.その結果,MS71Hpを過剰発現している野生株に,さらにSec71pそのものやDSDを共発現したところ,1.7倍,1.9倍にまでMS71Hp依存的な成熟型 接合因子量は増加すると予想される.Sec12pの細胞質領域はRer1p非依存的な静的残留,膜貫通領域はRer1p依存的な逆送シグナルを含むことが明らかとなった(Sato et al.,1996)ので,Sec12pのかわりにDap2pそのもの(DDD)と,膜貫通領域をSec12pのものと置換し完全に小胞体に局在化するようになったキメラ(DSD)を用いて解析を行った.その結果,MS71Hpを過剰発現している野生株に,さらにSec71pそのものやDSDを共発現したところ,1.7倍,1.9倍にまでMS71Hp依存的な成熟型 接合因子の分泌が上昇し,ともにMS71Hpと競争的効果を示した(表1).一方,DDDはベクターコントロールとほとんど差違が見られなかった.また,rer1遺伝子破壊株では,この効果は消失した.以上のことから,Rer1pはSec12pとSec71pの両者を認識する制限因子の一つであると結論した. 接合因子の分泌が上昇し,ともにMS71Hpと競争的効果を示した(表1).一方,DDDはベクターコントロールとほとんど差違が見られなかった.また,rer1遺伝子破壊株では,この効果は消失した.以上のことから,Rer1pはSec12pとSec71pの両者を認識する制限因子の一つであると結論した. 3)COPI輸送小胞とRer1p COPIはRothmanらによって動物細胞でゴルジ層板間輸送にはたらく輸送小胞上のコートタンパク質として同定された.近年,Letourncur,Cossonらの酵母を用いた研究によって,このCOPIの構成因子である -COP(Ret1p)などが,ゴルジ体から小胞体への逆送シグナルKKXXに結合すること,またそれらの変異株ではKKXXシグナルをもつタンパク質の局在に異常が見られることなどが明らかとなり,COPIが小胞体膜タンパク質のゴルジ体から小胞体への逆向き輸送に働く可能性が示唆されてきている. -COP(Ret1p)などが,ゴルジ体から小胞体への逆送シグナルKKXXに結合すること,またそれらの変異株ではKKXXシグナルをもつタンパク質の局在に異常が見られることなどが明らかとなり,COPIが小胞体膜タンパク質のゴルジ体から小胞体への逆向き輸送に働く可能性が示唆されてきている. そこで,Rer1pとCOPIとの関連を調べるために,rer1遺伝子破壊株と温度感受性変異株ret1-1の二重変異株を構築したところ,ret1-1変異株に比べ制限温度の低下が見られた.一方で,ret1-1mf 1mf 1mf 2bar1という株を構築し,この株におけるS12Mp,MS71Hp,MS63pの挙動を調べた(図5).いずれの場合もret1-1変異株は,多コピープラスミド上の発現による成熟型 2bar1という株を構築し,この株におけるS12Mp,MS71Hp,MS63pの挙動を調べた(図5).いずれの場合もret1-1変異株は,多コピープラスミド上の発現による成熟型 接合因子のハローを大きくする効果を示した.特にMS63Lpに関しては,単コピープラスミド上で発現させたときでもハローを形成した.これらの結果から,KKXXシグナルのような既知のシグナルをもたない小胞体タンパク質の局在化にもCOPIが関与していることが初めて明らかとなった.また,逆送過程にRer1pとCOPIが協調して働く可能性が示唆された. 接合因子のハローを大きくする効果を示した.特にMS63Lpに関しては,単コピープラスミド上で発現させたときでもハローを形成した.これらの結果から,KKXXシグナルのような既知のシグナルをもたない小胞体タンパク質の局在化にもCOPIが関与していることが初めて明らかとなった.また,逆送過程にRer1pとCOPIが協調して働く可能性が示唆された. <結論> 本研究によって,Rer1pはゴルジ体シス領域に局在し,Sec12p,Sec71p,Sec63pといった様々なタイプの小胞体膜タンパク質をおそらく小胞体へ逆送することによって局在化させていることが明らかとなった.また,MS71Hp過剰発現株を用いた解析から,Rer1pは少なくともSec12pとSec71pの両者を認識する制限因子の一つであると結論した.一方で,これらのKKXXシグナルを持たないタンパク質でさえもまたCOPIによる制御を受けていることが初めて示された.RER1とRET1との遺伝学的相互作用とあわせて考えると,Rer1pがゴルジ体において小胞体タンパク質を選別し,COPI小胞を介して逆送しているという可能性が有力なモデルとなりうるであろう(図7).現在,Rer1pのホモログが,植物,線虫,その他の酵母などで次々と発見されてきており,このRer1pを中心とした機構も真核生物に普遍的であると予想される.本研究で得られた知見が真核生物におけるモデルケースとなり,酵母だけではなく多細胞生物における小胞体タンパク質局在化機構の理解にもつながると考えている.  図2.間接蛍光抗体法によるRer1-3HAタンパク質の細胞内局在の解析.Rer1-3HApを多コピープラスミド上で発現しているrer1-2変異株を構築し,抗Ypt1p抗体(A),および抗HA抗体(B)を用いて間接蛍光抗体法による二重染色を行った. 図2.間接蛍光抗体法によるRer1-3HAタンパク質の細胞内局在の解析.Rer1-3HApを多コピープラスミド上で発現しているrer1-2変異株を構築し,抗Ypt1p抗体(A),および抗HA抗体(B)を用いて間接蛍光抗体法による二重染色を行った. 図3.細胞分画法によるRer1-3HApの局在の解析.Rer1-3HApを単コピープラスミド上で発現している酵母細胞破砕液を300xg,13,000xg,100,000xgの分画遠心にかけ,このうちP13画分を1.2M(41%),1.5M(51%)ショ糖からなるgradientの上に重層し,さらに4時間85,000xgで遠心を行った.Sec12p,Pho8p,Kex2p,Och1pはそれぞれ小胞体,液胞,トランスゴルジ,シスゴルジの局在マーカーとして用いている. 図3.細胞分画法によるRer1-3HApの局在の解析.Rer1-3HApを単コピープラスミド上で発現している酵母細胞破砕液を300xg,13,000xg,100,000xgの分画遠心にかけ,このうちP13画分を1.2M(41%),1.5M(51%)ショ糖からなるgradientの上に重層し,さらに4時間85,000xgで遠心を行った.Sec12p,Pho8p,Kex2p,Och1pはそれぞれ小胞体,液胞,トランスゴルジ,シスゴルジの局在マーカーとして用いている. 図4. 図4. 接合因子(Mf 接合因子(Mf 1p)と様々な小胞体膜タンパク質との融合タンパク質の構築.Sec71p,Sec63pについて新たにMf 1p)と様々な小胞体膜タンパク質との融合タンパク質の構築.Sec71p,Sec63pについて新たにMf 1pとの融合タンパク質を構築し,それぞれMS71Hp,MS63Lpと名づけた.また,これらのC末端にヒトインフルエンザウィルスヘマグルチニン(HA)およびc-myc由来のペプチドを結合し,それらに対するモノクローナル抗体12CA5,9E10によって認識できるようにした. 1pとの融合タンパク質を構築し,それぞれMS71Hp,MS63Lpと名づけた.また,これらのC末端にヒトインフルエンザウィルスヘマグルチニン(HA)およびc-myc由来のペプチドを結合し,それらに対するモノクローナル抗体12CA5,9E10によって認識できるようにした. 図5.野生株,rer1遺伝子破壊株,およびret1-1変異株におけるS12Mp,MS71Hp,MS63Lpの挙動.S12Mp,MS71HpあるいはMS63Lpを単コピー(CENと表記),多コピー(2 図5.野生株,rer1遺伝子破壊株,およびret1-1変異株におけるS12Mp,MS71Hp,MS63Lpの挙動.S12Mp,MS71HpあるいはMS63Lpを単コピー(CENと表記),多コピー(2 と表記)プラスミド上で発現している野生株,rer1遺伝子破壊株,そしてret1-1変異株についてハローアッセイを行った. と表記)プラスミド上で発現している野生株,rer1遺伝子破壊株,そしてret1-1変異株についてハローアッセイを行った.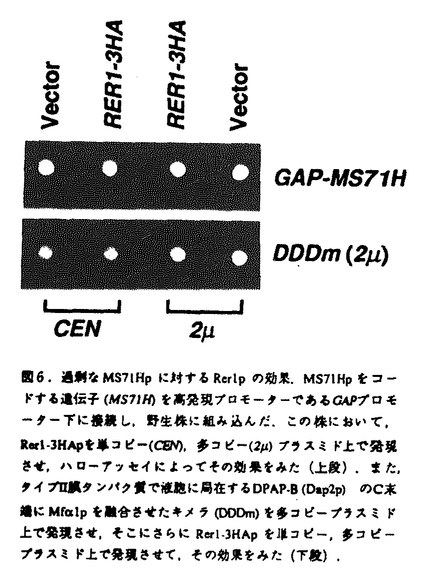 図6.過剰なMS71Hpに対するRer1pの効果.MS71Hpをコードする遺伝子(MS71H)を高発現プロモーターであるGAPプロモーター下に接続し,野生株に組み込んだ.この株において,Rer1-3HApを単コピー(CEN),多コピー(2 図6.過剰なMS71Hpに対するRer1pの効果.MS71Hpをコードする遺伝子(MS71H)を高発現プロモーターであるGAPプロモーター下に接続し,野生株に組み込んだ.この株において,Rer1-3HApを単コピー(CEN),多コピー(2 )プラスミド上で発現させ,ハローアッセイによってその効果をみた(上段).また,タイプII膜タンパク質で液胞に局在するDPAP-B(Dap2p)のC末端にMf )プラスミド上で発現させ,ハローアッセイによってその効果をみた(上段).また,タイプII膜タンパク質で液胞に局在するDPAP-B(Dap2p)のC末端にMf 1pを融合させたキメラ(DDDm)を多コピープラスミド上で発現させ,そこにさらにRer1-3HApを単コピー,多コピープラスミド上で発現させて,その効果をみた(下段). 1pを融合させたキメラ(DDDm)を多コピープラスミド上で発現させ,そこにさらにRer1-3HApを単コピー,多コピープラスミド上で発現させて,その効果をみた(下段). 図7.膜タンパク質の小胞体局在化におけるRer1pの機能モデル. 図7.膜タンパク質の小胞体局在化におけるRer1pの機能モデル. 表1.MS71Hpの細胞内局在におけるSec71p,DSDによる競争効果.MS71Hpをコードする遺伝子(MS71H)を高発現プロモーターであるGAPプロモーター下に接続し,野生株およびrer1遺伝子破壊株に組み込んだ株において,Sec71p,DDD,DSDを多コピープラスミド上で発現させ,ハローアッセイによってそれらの競争効果をみた. 表1.MS71Hpの細胞内局在におけるSec71p,DSDによる競争効果.MS71Hpをコードする遺伝子(MS71H)を高発現プロモーターであるGAPプロモーター下に接続し,野生株およびrer1遺伝子破壊株に組み込んだ株において,Sec71p,DDD,DSDを多コピープラスミド上で発現させ,ハローアッセイによってそれらの競争効果をみた. |
| 審査要旨 | | 本論文は3章からなり,第1章はRER遺伝子産物の細胞内局在について,第2章はRer1タンパク質の小胞体局在化装置としての一般性について,第3章はRer1タンパク質依存性のリサイクリングにおけるCOPI小胞の関与について述べられている. すべての真核細胞は,緻密に分化したオルガネラで構成されている.そのそれぞれのオルガネラに担われた役割を最高の効率で果たすためには,各オルガネラを構成するタンパク質が正しく選別されることが必須であり,そこではタンパク質のもつオルガネラ局在化シグナルとそれを認識する選別装置のはたらきがきわめて重要である.では,小胞体で機能するタンパク質は,どのような選別をうけているのだろうか?これまでに,HDELやKKXXといったC末端のペプチド配列が小胞体局在化シグナルとして働くことが明らかとなってきたが,このようなシグナルを持たない小胞体タンパク質も多く存在している. 出芽酵母Saccharomyces cerevisiaeのSec12タンパク質(Sec12p)は,タイプII膜タンパク質で,小胞体からの輸送小胞の形成に必須な因子として同定された.このタンパク質は上述のような既知の小胞体局在化シグナルは持っていないが,定常状態においてその大部分は小胞体に局在しており,輸送小胞上にもほとんど検出されない.しかしながら,徐々にゴルジ体シス領域における糖鎖修飾を受けることから,このタンパク質の小胞体局在化には小胞体から出ないようにする静的残留機構とそれでも漏れ出てしまったものを小胞体に戻す動的逆送機構の両者がはたらいていると考えられる.西川は,これらの機構を解析するために,Sec12pと 接合因子(Mf 接合因子(Mf 1p)の融合タンパク質の局在が異常になるような2つの劣性変異株rerを獲得した.本研究は,このうちRER1遺伝子産物に焦点をあて,その細胞内における局在,様々な膜タンパク質の小胞体局在化における役割を分子レベルで解明することを目指したものである. 1p)の融合タンパク質の局在が異常になるような2つの劣性変異株rerを獲得した.本研究は,このうちRER1遺伝子産物に焦点をあて,その細胞内における局在,様々な膜タンパク質の小胞体局在化における役割を分子レベルで解明することを目指したものである. 修士課程において佐藤は,野生型RER1遺伝子のクローニングを試み,188アミノ酸からなる膜4回貫通タンパク質をコードする新規の遺伝子を同定した.そこで本研究では,Rer1pのC末端にHAエピトープを結合した遺伝子(RER1-3HA)を構築した.このRER1-3HAは,単コピーでrer1-2変異を相補した.そこで,このRER1-3HA遺伝子産物の細胞内局在を,間接蛍光抗体法によって解析したところ,酵母のゴルジ体の染色パターンが観察された.また,細胞分画法による解析ではゴルジ体シス領域に局在するOch1pと同様の挙動を示した.これらのことから,Rer1pは,シスゴルジ体膜に局在し,静的残留というよりもむしろSec12pをゴルジ体から小胞体へ戻す逆送過程に関与していると考えられた. 次に,Rer1pの機能の一般性を知るために,Sec12p以外の小胞体膜タンパク質についても解析を試みた.Sec12p-Mf 1p融合タンパク質(S12Mp)に加えて,Sec12pとは正反対のトポロジーをとるSec71p,3回膜を貫通しているSec63pについて新たにMf 1p融合タンパク質(S12Mp)に加えて,Sec12pとは正反対のトポロジーをとるSec71p,3回膜を貫通しているSec63pについて新たにMf 1pとの融合タンパク質を構築し,それぞれMS71Hp,MS63Lpと名づけた.まず,野生株,rer1遺伝子破壊株におけるMS71HpあるいはMS63Lpの挙動をハローアッセイによって調べた.MS71Hp,MS63Lpともにrer1遺伝子破壊株において成熟型 1pとの融合タンパク質を構築し,それぞれMS71Hp,MS63Lpと名づけた.まず,野生株,rer1遺伝子破壊株におけるMS71HpあるいはMS63Lpの挙動をハローアッセイによって調べた.MS71Hp,MS63Lpともにrer1遺伝子破壊株において成熟型 接合因子の分泌によるハローを形成したことから,これらの小胞体局在にもまたRer1pが重要であることが明らかになった.一方,たとえ野生株であってもMS71Hp,MS63Lpを多コピープラスミド上で過剰発現したときは,ハローを形成した.このことから,これらのタンパク質の小胞体局在化の機構には量的な制限因子が存在し,それが飽和していると予想された. 接合因子の分泌によるハローを形成したことから,これらの小胞体局在にもまたRer1pが重要であることが明らかになった.一方,たとえ野生株であってもMS71Hp,MS63Lpを多コピープラスミド上で過剰発現したときは,ハローを形成した.このことから,これらのタンパク質の小胞体局在化の機構には量的な制限因子が存在し,それが飽和していると予想された. 次に,Rer1pがその制限因子である可能性について検証した.もしそうであるならば,Rer1pの発現量も同時に増加させることによって,過剰分のMS71Hpによる成熟型 接合因子の分泌が抑制されると思われる.実際に,Rer1pは単コピープラスミド上で80%,多コピープラスミド上で50%にまで過剰なMS71Hpによって生じる成熟型 接合因子の分泌が抑制されると思われる.実際に,Rer1pは単コピープラスミド上で80%,多コピープラスミド上で50%にまで過剰なMS71Hpによって生じる成熟型 接合因子の分泌を抑制した.さらにもし,Sec12p,Sec71pが共通の因子によって認識されているならば,MS71HpだけでなくさらにSec71pそのものやSec12pの発現も同時に増加させることによって競争がおこり,結果としてMS71Hpから生じる成熟型 接合因子の分泌を抑制した.さらにもし,Sec12p,Sec71pが共通の因子によって認識されているならば,MS71HpだけでなくさらにSec71pそのものやSec12pの発現も同時に増加させることによって競争がおこり,結果としてMS71Hpから生じる成熟型 接合因子量は増加すると予想される.Sec71pまたはSec12pのRer1p依存的な逆送シグナルを含む膜貫通領域を持ったDSDをMS71Hpを過剰発現している野生株に共発現したところ,1.7倍,1.9倍にまで成熟型 接合因子量は増加すると予想される.Sec71pまたはSec12pのRer1p依存的な逆送シグナルを含む膜貫通領域を持ったDSDをMS71Hpを過剰発現している野生株に共発現したところ,1.7倍,1.9倍にまで成熟型 接合因子の分泌が上昇した.rer1遺伝子破壊株では,この効果は消失した.以上のことから,Rer1pはSec12pとSec71pの両者を認識する制限因子の一つであると結論した. 接合因子の分泌が上昇した.rer1遺伝子破壊株では,この効果は消失した.以上のことから,Rer1pはSec12pとSec71pの両者を認識する制限因子の一つであると結論した. 近年,コートタンパク質の1種であるCOPIがKKXXシグナルをもつ小胞体膜タンパク質のゴルジ体から小胞体への逆向き輸送に働くことが示されてきている.COPIサブユニットの変異の一つである温度感受性変異ret1-1とrer1遺伝子破壊株との二重変異株を構築したところ,ret1-1変異株に比べ制限温度の低下が見られた.一方で,ret1-1 mf 1m 1m 2 bar1という株を構築し,この株におけるS12Mp,MS71Hp,MS63pの挙動を調べたところ,いずれの場合もret1-1変異株は,多コピープラスミド上の発現による成熟型 2 bar1という株を構築し,この株におけるS12Mp,MS71Hp,MS63pの挙動を調べたところ,いずれの場合もret1-1変異株は,多コピープラスミド上の発現による成熟型 接合因子のハローを大きくする効果を示した.これらの結果から,KKXXシグナルのような既知のシグナルをもたない小胞体タンパク質の局在化にもCOPIが関与していることが初めて明らかとなった.また,逆送過程にRer1pとCOPIが協調して働く可能性が示唆された. 接合因子のハローを大きくする効果を示した.これらの結果から,KKXXシグナルのような既知のシグナルをもたない小胞体タンパク質の局在化にもCOPIが関与していることが初めて明らかとなった.また,逆送過程にRer1pとCOPIが協調して働く可能性が示唆された. なお,本研究の第1章は西川周一氏と中野明彦氏との,また第2章,第3章は佐藤美由紀氏と中野明彦氏との共同研究であるが,論文提出者が主体となって解析及び検証を行ったもので,論文提出者の寄与が十分であると判断する. これらの成果は,タンパク質の細胞内局在機構の解明に大きく寄与するものであり,審査委員は全員一致して博士(理学)の学位にふさわしい業績と認めた. |