| 内容要旨 | | 窒素分子は化学的に非常に安定である一方、大気中に豊富に存在し化学工業における窒素資源となっている。現在の合成窒素化合物のほとんどは、Haber-Bosch法によって得られるアンモニアを窒素源としているが、この方法は高温高圧の激しい条件を必要とする。従って穏和な条件下において窒素分子から直接に種々の含窒素化合物を合成するプロセスは、次世代の窒素固定法として開発が期待される。遷移金属上に配位した窒素分子が穏和な条件下に化学変換を受ける例はいくつか知られており、これまでに種々の遷移金属窒素錯体の反応性が検討されている。本研究では一般式[M(N2)2(P)4](M=Mo,W;P=tertiary phosphine)で示される窒素錯体の反応性に着目し、金属上での窒素分子の段階的な化学変換による、有機窒素化合物とりわけ含窒素複素環化合物の合成について研究を展開した。 PMe2Phを補助配位子とするW窒素錯体1は、ハロゲン化水素によるプロトン化を受け、対応するヒドラジド(2-)錯体2a-cを与える(Scheme 1)。錯体2aとフタルアルデヒドを塩酸存在下にTHF中室温で反応させると、末端窒素原子を含んだ五員環ラクタム構造を有するヒドラジド(2-)型錯体3aが生成した(Scheme 1)。錯体3aをCH2Cl2中0℃-室温でHBrと処理すると、W_N結合の切断によりN_アミノフタルイミジンが中程度の収率で遊離した。一方、THF中18-クラウン-6エーテル存在下における3aとKOHとの反応では、高選択的なN-N結合切断が達成され、フタルイミジンとNH3が得られた(収率,各75,81%)。 1,2-ビス(ジフェニルホスフィノ)エタン(dppe)を補助配位子とするMo,W窒素錯体4a,bのプロトン化ではカチオン性のヒドラジド(2-)錯体5a-c+が得られるが、HBF4存在下でのW錯体5b+とフタルアルデヒドの反応ではジアゾアルカン錯体6+が高収率で得られた。錯体6+は強プロトン酸(HBF4・ether,CF3SO3H)に対しては反応性を示さなかったが、等モルのAlCl3によりTHF中還流条件下でフタルイミジン環を有する7+へ異性化した(Scheme2)。電気的に中性な錯体2aと比べカチオン錯体5b+の反応性が低いのは、金属上の正電荷および電子供与性の小さいホスフィン配位子によって末端窒素の求核性が低下しているためと考えられる。  Scheme 1 Scheme 1 Mo,Wのヒドラジド(2-)錯体5a,b+は、2,5-ジメトキシ-2,5-ジヒドロフランと室温で酸触媒存在下に反応し、2種類の -ラクタム構造を有する錯体が生成した。短時間の反応(5a+,3h;5b+,1h)では、(1,3-ジヒドロ-2-オキソ-2H-ピロール-1-イル)イミド配位子を有する錯体8a,b+が選択的に得られた。この錯体8a,b+を酸性条件下に置くかまたは塩基と処理すると室温でゆっくり異性化が進行し、二重結合の位置が異なる(1,5-ジヒドロ-2-オキソ-2H-ピロール-1-イル)イミド配位子を有する錯体9a,b+へ完全に変換された(Scheme 3)。これらの錯体は13CNMRにおいて対応する有機化合物と良く一致するスペクトルをそれぞれ与えるが、さらにW錯体8b+,9b+のX線構造解析により -ラクタム構造を有する錯体が生成した。短時間の反応(5a+,3h;5b+,1h)では、(1,3-ジヒドロ-2-オキソ-2H-ピロール-1-イル)イミド配位子を有する錯体8a,b+が選択的に得られた。この錯体8a,b+を酸性条件下に置くかまたは塩基と処理すると室温でゆっくり異性化が進行し、二重結合の位置が異なる(1,5-ジヒドロ-2-オキソ-2H-ピロール-1-イル)イミド配位子を有する錯体9a,b+へ完全に変換された(Scheme 3)。これらの錯体は13CNMRにおいて対応する有機化合物と良く一致するスペクトルをそれぞれ与えるが、さらにW錯体8b+,9b+のX線構造解析により -ラクタム部分の構造を決定した。錯体8,9+は、いずれも(2-ヒドロキシピロール-1-イル)イミド錯体(10+)を経由して生成するが、10+の3-位へのプロトン化が5-位よりも速いために始めに8+が生成し、それが10+を経由して徐々に熱力学的に安定な9+に異性化すると考えられる。 -ラクタム部分の構造を決定した。錯体8,9+は、いずれも(2-ヒドロキシピロール-1-イル)イミド錯体(10+)を経由して生成するが、10+の3-位へのプロトン化が5-位よりも速いために始めに8+が生成し、それが10+を経由して徐々に熱力学的に安定な9+に異性化すると考えられる。 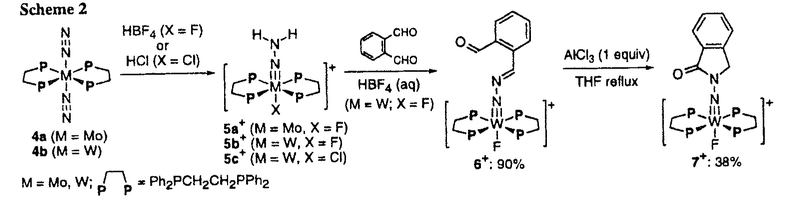 Scheme 2 Scheme 2 Scheme 3 Scheme 3 ヒドラジド(2-)錯体2および5+は、2,5-ジメトキシテトラヒドロフランと酸触媒存在下に室温で反応し、末端窒素を含んだピロール環を有する(1-ピロリル)イミド錯体を良好な収率で与えた(Scheme 4)。 ピロリルイミド錯体11a-cのKOHによる分解反応を種々の条件下室温で行い、ピロール,N-アミノピロールの遊離を検討した。窒素雰囲気下アルコール中の反応では一般に選択性が低く(ピロール/N-アミノピロール=0.12-2.7)、錯体およびアルコール(MeOH,EtOH,2-PrOH)の種類による選択性の違いに規則性は見られない。一方EtOH中の反応をCO雰囲気下(1気圧)で行うと、11a,bのいずれにおいてもN-アミノピロールの選択性が向上する事が判明した(収率(%)(各11a,11bより):N-アミノピロール(89,92),ピロール(5,2))。窒素雰囲気下THF中では18-クラウン-6エーテルの存在下に11bの分解反応が進行して、ピロールとNH3がそれぞれ82,85%で生成し、N-アミノピロールの収率はわずかに5%となった。錯体11とKOHの反応機構はScheme 5のように推測され、Wに -受容性の強いCOが配位することによってN-N結合の還元的切断が抑制されるとpath aが有利となり、非プロトン性溶媒中では配位窒素のプロトン化が抑えられてpath bの方が優位に進行する。 -受容性の強いCOが配位することによってN-N結合の還元的切断が抑制されるとpath aが有利となり、非プロトン性溶媒中では配位窒素のプロトン化が抑えられてpath bの方が優位に進行する。 ピロリルイミド錯体11b,12a,b+をTHF中LiAlH4で還元し、MeOHで処理するとピロールとNH3が主生成物として得られた。錯体11bの還元は50℃で24hかけて進行して、ピロールとNH3をそれぞれ75,74%で遊離し、金属中心はヘキサヒドリド錯体WH6(PMe2Ph)3(13)として回収された(31%)。それに対して12a,b+の還元は室温以下で進行し、高収率で含窒素化合物を遊離して(収率(%)(各12a+,12b+より):ピロール(68,82),N-アミノピロール(32,5),NH3(53,72))、テトラヒドリド錯体MH4(dppe)2(14a(M=Mo):47%,14b(M=W):19%)を与えた。14aは1気圧の窒素下光照射により窒素錯体4aへ変換される(95%)ことから、金属上での変換による窒素分子からのピロール類の合成サイクルが組み立てられる(Scheme 6)。  Scheme 4 Scheme 4 Scheme 5 Scheme 5 dppeを補助配位子とするピロリルイミド錯体12a-c+のスルホン化,シアノ化,ホルミル化,アシル化および低温でのブロモ化(12a+, 0℃;12b+, 0℃;12b+, -10℃)では -10℃)では -置換生成物のみが収率良く得られ、NCSを用いたクロロ化のみ例外的に -置換生成物のみが収率良く得られ、NCSを用いたクロロ化のみ例外的に -選択性を示した(Scheme 7)。通常のピロールの親電子置換反応は -選択性を示した(Scheme 7)。通常のピロールの親電子置換反応は -選択的である事が知られているが、錯体12+においてはかさ高いdppe配位子が立体的に -選択的である事が知られているが、錯体12+においてはかさ高いdppe配位子が立体的に -位での反応を阻害するため、このような -位での反応を阻害するため、このような -選択性が発現したと考えられる。また本反応を利用して分子状窒素より -選択性が発現したと考えられる。また本反応を利用して分子状窒素より -ヘプチルピロールが合成された。 -ヘプチルピロールが合成された。 錯体2aの配位子置換によって得られる15a,bと2,4,6-トリメチルピリリウムカチオンの反応では、末端窒素上でのピリジン環の形成が収率良く進行した。得られた(1-ピリジニオ)イミド錯体16a,b+はMeOH中KOHによる分解を受け、高選択的に2,4,6-トリメチルピリジンとNH3を与えた(Scheme 8)。錯体16+はヒドラジジウム錯体(M=N_NR3+)の1種と考えられるものであるが、ヒドラジジウム錯体自体の例がごく少なく、またN-N結合の切断を含めてその反応性はほとんど知られていない。上の結果は窒素分子からの置換ピリジンの合成反応としても、また窒素固定関連錯体の反応性に関する新しい知見としても興味深い。  Scheme 6 Scheme 6 Scheme 7 Scheme 7 Scheme 8 Scheme 8 |
| 審査要旨 | | 窒素分子は化学工業における重要な窒素資源であるが、化学的に非常に不活性であるため、その変換には多大なエネルギーを要する。穏和な条件下において窒素分子から直接に種々の含窒素化合物を合成するプロセスは、次世代の窒素固定法として開発が期待されるものである。本論文は、6族遷移金属錯体上での窒素分子の変換反応について述べたものであり、第1章の序論に加えて以下の4章から構成されている。 第2章では、モリブデン,タングステン錯体上の配位窒素から窒素-炭素二重結合の形成を経て誘導されるジアゾアルカン配位子の変換反応について述べている。まずはじめに、窒素-炭素二重結合と共役した炭素-炭素不飽和結合を有するジアゾアルカン配位子が、ジアルキルクプラートの共役付加を受けてアルケニルジアゼニド配位子に変換されることを見出している。さらにこの配位子をプロトンまたはハロゲン化アルキル等でトラップすることにより、ジアゾアルカン配位子上へ1つまたは2つの置換基の導入を行っており、金属錯体上での含窒素配位子の変換反応として興味が持たれる。 第3章では、五員環ラクタム構造を有する含窒素配位子の合成と構造の解析について述べている。ここではモリブデン,タングステン窒素錯体のプロトン化によって生成するヒドラジド(2-)錯体を用い、フタルアルデヒドまたは2,5-ジメトキシ-2,5-ジヒドロフランとの縮合反応から、それぞれフタルイミジン環,または2種類の異性体構造を有するジヒドロ-2H-ピロール-2-オン環がヒドラジド配位子上で形成されることを見出している。生成した新規錯体を単離して、それらの性質について構造解析および分光学的測定から詳細に検討しており,そこで得られた知見は類似の環構造を有する有機化合物との比較において意義深い。さらに、含窒素配位子の金属上からの切断についても検討しており、フタルイミジン,N-アミノフタルイミジンの遊離に成功している。 第4章では、モリブデン,タングステン錯体上でのピロール構造を有する配位子の構築、およびそれら錯体上のピロール環の反応性について述べている。はじめに、第3章と類似の手法でヒドラジド(2-)錯体と2,5-ジメトキシテトラヒドロフランとの縮合反応から、1,2-ビス(ジフェニルホスフィノ)エタンを補助配位子としピロール環を有するピロリルイミド錯体を合成している。この錯体をリチウムアルミニウムハイドライドで還元することによって、高収率でピロールおよびN-アミノピロールが錯体上から遊離することを見出している。さらに還元反応後の金属中心を再び始めの窒素錯体に変換できることも示しており、遷移金属錯体を用いた窒素固定反応として興味深い合成サイクルを提示している。また、錯体上のピロール環での各種親電子置換反応において、補助配位子の立体障害から高い -選択性が発現することを見出しており、先の還元反応との組み合わせによって -選択性が発現することを見出しており、先の還元反応との組み合わせによって -アルキルピロールの合成に成功している。本反応は通常のピロールの位置選択性を逆転させたものであり、 -アルキルピロールの合成に成功している。本反応は通常のピロールの位置選択性を逆転させたものであり、 -置換ピロール類の合成法としての有用性も期待される。 -置換ピロール類の合成法としての有用性も期待される。 第5章では、第4章に引き続きピロリルイミド錯体の反応性について述べている。まずジメチルフェニルホスフィンならびにカルボニル,アルキン等の補助配位子を有するピロリルイミド錯体を合成し、これら補助配位子が錯体の構造,分光学的性質に与える影響について考察している。続いてこの錯体から遊離するピロール,N-アミノピロールの選択性について、補助配位子の電子的効果の立場から説明し、実際にピロールとN-アミノピロールを高収率でつくり分けることに成功している。本章で述べられているような、含窒素配位子の遊離における補助配位子の電子的効果については、類似錯体においてこれまであまり検討されておらず、新たな知見を与えるものである。 以上のように本論文では、モリブデン,タングステン錯体上で活性化を受けた窒素分子を段階的に化学変換することによって、種々の含窒素複素環化合物へ誘導する合成法を確立している。このような窒素分子を直接窒素源として用いる有機合成法はこれまで例がほとんどない。したがって本論文の成果は次世代の窒素固定法の開発に対して重要な知見を与えることが期待され、有機合成化学,有機工業化学への貢献はきわめて大きい。 よって本論文は博士(工学)の学位請求論文として合格と認められる。 |