藍藻は水圏における基礎生産を担うとともに、生息環境が陸上生物と大きく異なることから、極めて特徴的な二次代謝産物を多く生産し、有用生物活性物質の探索源として注目を集めている。すでに藍藻より抗ガン、抗菌、抗カビ活性などを指標として新規物質が数多く単離されている。しかし、酵素阻害物質に関しては、酵素の生体内での役割の解明、各種病態解析のための試薬、または治療薬としての開発が期待され、様々な陸上生物より有用な物質が探索されているにもかかわらず、藍藻を対象とした研究例はほとんどない。そこで本研究では、100種以上の微細藻類の酵素阻害物質のスクリーニングで顕著な阻害活性が認められた3種の藍藻から6種のプロテアーゼ阻害活性を指標として活性成分の単離と構造解析を試みた。その結果13種のペプチド性化合物を得ることができた。概要は以下の通りである。 1.Oscillatoria agardhii(NIES-204)よりエラスターゼおよびキモトリプシン阻害物質oscillapeptin類の単離・構造決定 国立環境研究所より分譲を受けたO.agardhii(NIES-204)をCB培地用いて25℃、明暗サイクル12L:12D、250 E-m-2・s-1の条件下で通気培養した。400Lの培養液から得られた138gの凍結乾燥藻体を80%メタノールおよびメタノールで抽出し、水とエーテルで二層分配後、水層をさらに水とブタノールで分配した。活性の認められたブタノール画分をODSのフラッシュクロマトグラフィーに付し、60%メタノールで溶出した活性画分からODSのHPLCによりoscillapeptin A(1),B(2)と命名した活性物質をそれぞれ23.3,5.6mg単離した。 E-m-2・s-1の条件下で通気培養した。400Lの培養液から得られた138gの凍結乾燥藻体を80%メタノールおよびメタノールで抽出し、水とエーテルで二層分配後、水層をさらに水とブタノールで分配した。活性の認められたブタノール画分をODSのフラッシュクロマトグラフィーに付し、60%メタノールで溶出した活性画分からODSのHPLCによりoscillapeptin A(1),B(2)と命名した活性物質をそれぞれ23.3,5.6mg単離した。  これらの物質の構造をFAB-MSおよび各種2次元NMRスペクトルの解析により決定した。1と2の分子式は1H,13C NMRデータおよび高分解能FAB-MSよりそれぞれC56H77N7O18S、C57H79N7O18Sと決定した。アミノ酸分析および各種2次元NMRスペクトルの解析により構成アミノ酸の存在が確認された。構成アミノ酸残基の配列順序はHMBCおよびNOESYスペクトルの相関から決定した。1と2のエラスターゼ阻害活性はそれぞれIC50=0.3,0.05 g/mlであり、キモトリプシン阻害活性はそれぞれIC50=2.2,2.1 g/mlであり、キモトリプシン阻害活性はそれぞれIC50=2.2,2.1 g/mlであった。 g/mlであった。 2.O.agardhii(NIES-204)よりエラスターゼおよびキモトリプシン阻害物質microviridin類の単離・構造決定 同藍藻よりエラスターゼおよびキモトリプシン阻害活性を有する活性物質microviridin D(3),E(4),F(5)をそれぞれ8.8,12.6,7.6mgを単離・精製した。阻害物質3,4,5の分子式は高分解能FAB-MSによりC84H107N17O26S,C82H100N14O24,C82H102N14O25と決定され、これらの物質の構造はアミノ酸分析、FAB-MSおよび各種2次元NMRスペクトルの解析などの機器分析によりmicroviridinタイプのペプチドであると決定した。各アミノ酸の立体はキラルカラムを用いるGC分析により全てのアミノ酸がL型であると決定した。3,4,5のエラスターゼ阻害活性は、それぞれIC50=0.7,0.6,5.8 g/mlであった。3と4はキモトリプシンに対してそれぞれIC50=1.2,1.1 g/mlであった。3と4はキモトリプシンに対してそれぞれIC50=1.2,1.1 g/mlで阻害活性を示したが、5は阻害活性を示さなかった。 g/mlで阻害活性を示したが、5は阻害活性を示さなかった。  3.O.agardhii(NIES-204)よりagardhipeptin類の単離・構造決定 O.agardhii(NIES-204)の抽出液を溶媒分画後、活性の認められたブタノール画分をODSのフラッシュクロマトグラフィーに付し、メタノールで溶出した活性画分からODSのHPLCによりagardhipeptin A(6),B(7)と命名した物質をそれぞれ8.0,6.7mg単離した。6と7の分子式は1H,13C NMRデータおよび高分解能FAB-MSよりそれぞれC43H51N11O7,C57H69N11O8と決定した。1H NMRスペクトルより6と7は、ペプチド性の化合物であることが示唆され、アミノ酸分析および2D NMRの解析の結果、構成アミノ酸が確認された。 6と7は不飽和度およびニンヒドリン試薬に対し陰性であることから、環状構造を持つことが示唆された。6と7の構成アミノ酸残基の配列順序はHMBCおよびNOESYスペクトルの相関からcyclo(-His1-Gly2-Trp3-Pro4-Trp5-Gly6-Leu7-)およびcyclo(-Trp1-Leu2-Pro3-Trp4-Ala5-Pro6-Trp7-Val8-)であると決定した。6と7の構成アミノ酸の立体は酸加水分解物をL-FDAA誘導体化し、HPLC分析によりすべてのアミノ酸がL型であると決定した。  Agardhipeptin A(6)はプラスミン対し、阻害活性がIC50=65 g/mlであったが、agardhipeptin B(7)は100 g/mlであったが、agardhipeptin B(7)は100 g/mlで阻害活性を示さなかった。 g/mlで阻害活性を示さなかった。 4.O.agardhii(NIES-204)よりanabaenopeptin類の単離・構造決定 上述の阻害物質以外にO.agardhii(NIES-204)より既知物質anabaenopeptin B(8)とともに、新規anabaenopeptin C(9),D(10)を単離・精製することができた。これら物質の構造はアミノ酸分析および各種2次元NMRの解析によりウレイド結合を有する19員環の環状ペプチドであると決定した。  5.O.agardhii(NIES-205)よりトリプシンおよびトロンビン阻害物質aeruginosin類の単離・構造決定 国立環境研究所より分譲を受けたO.agardhii(NIES-205)を上記の条件で大量培養した。350Lの培養液から得られた119gの凍結乾燥藻体を80%メタノールで抽出し、溶媒分画、ODSのフラッシュクロマトグラフィーおよびHPLCによりaeruginosin205-A(11),B(12)をそれぞれ24.5,7.0mg単離した。  11と12はともにFAB-MSにより、分子量は804と推定された。イオンピークの分裂パターン(m/z805/807,725/727;3:1)により塩素原子を1個有すること、m/z725(M-SO3+H)+に硫酸基が脱離したピークが観測されたことから硫酸基の存在が示唆された。11と12の分子式は1H,13C NMRデータおよびFAB-MSよりC34H53N6O12CISと決定した。各種2D NMRスペクトルの解析の結果、Plas(phenyllactic acid 2-O-sulfate)、Hleu(3-hydroxyleucine),Ccoi(2-carboxy-6-chlorooctahydroindole)、Agma(agmatine)、xylopyranoseの存在が明らかになった。 -アノマープロトンの結合定数よりxylopyranoseは -アノマープロトンの結合定数よりxylopyranoseは -結合していることが示唆された。硫酸基の位置はm/z575(M-Plas+H)+のFAB-MSのフラグメントピークより決定した。これらの5つのユニットの配列順序は、HMBC相関およびNOESY相関により決定した。11と12は同じ平面構造を有するがPlasとHleuの立体が異なっていた。PlasとHleuの立体は酸加水分解物をそれぞれl-menthol誘導体化とMarfey誘導体化し、HPLC分析により決定した。xylopyranoseの立体は酸加水分解物をTFAイソプロピル化し、GC分析によりD型と決定した。 -結合していることが示唆された。硫酸基の位置はm/z575(M-Plas+H)+のFAB-MSのフラグメントピークより決定した。これらの5つのユニットの配列順序は、HMBC相関およびNOESY相関により決定した。11と12は同じ平面構造を有するがPlasとHleuの立体が異なっていた。PlasとHleuの立体は酸加水分解物をそれぞれl-menthol誘導体化とMarfey誘導体化し、HPLC分析により決定した。xylopyranoseの立体は酸加水分解物をTFAイソプロピル化し、GC分析によりD型と決定した。 Aeruginosin 205-A(11),B(12)はトリプシン阻害活性がともにIC50=0.07 g/mlであり、トロンビンに対しそれぞれ阻害活性がIC50=1.5,0.17 g/mlであり、トロンビンに対しそれぞれ阻害活性がIC50=1.5,0.17 g/mlであった。 g/mlであった。 6.Anabaena circinalis(NIES-41)よりパパイン阻害物質circinamideの単離・構造決定 国立環境研究所より分譲を受けたA.circinalis(NIES-41)を10L瓶を用いて上記の条件で14-18日間大量培養し、480Lの培養液から140gの凍結乾燥藻体を得た。これを80%メタノールで抽出し、溶媒分画、ODSのフラッシュクロマトグラフィーおよびHPLCにより阻害物質circinamide(13)を13.5mg単離した。 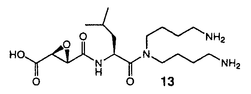 13の分子式は1H,13C NMRデータおよび高分解能FAB-MSよりC18H34N4O5と決定した。酸加水分解後、アミノ酸分析、FAB-MSおよび各種2次元NMRの解析により2,3-epoxy succinic acid,Leu,N-(4-aminobutyl)-1,4-butandiamineの構成ユニットの存在が確認された。ユニットの配列順序はHMBCおよびNOESYの相関により決定した。Leuの立体はMarfey法によりL型であると決定した。エポキシの相対立体は結合定数(J=2.1Hz)よりtransと決定し、絶対立体はエポキシを選択的開環し、キラルカラムを用いるGCで分析することにより、(2S,3S)と決定した。13のパパイン阻害活性はIC50=0.4 g/mlであった。 g/mlであった。 以上、3種の藍藻から13種のペプチド性の化合物を単離・構造決定することができた。そのうち、12種は新規化合物で、9種は強いプロテアーゼ阻害活性を示し、藍藻が新しいプロテアーゼ阻害物質の探索源として有望であることが示唆された。 |