生物活性の高い有機化合物を合成するためには、光学純度の高い鏡像異性体の合成が要求される。近年、反応や反応種を制御する手法や理論の急速な進歩で光学活性物質の合成、あるいは不斉合成が大きく発展した。不斉合成は、純粋な有機合成化学的手法に限ることなく、生物がもともと持っているキラリティーを反応に利用することもできる。すなわち有機合成経路の重要な一部に、不斉な酵素反応、あるいは微生物菌体による生体触媒反応を利用することにより、全体の効率と純度を上げて付加価値の高い有用物質を合成することが可能である。昆虫の性フェロモンは、一般に鎖状または環状の炭化水素を基本とした比較的簡単な有機化合物でありながら、種特異的が高く、きわめて微量で効果を現すので、昆虫の生態制御あるいは害虫の防除といった応用面からも重要な物質である。しかしこれらは天然からはごく微量しか得られず、しかも多くの場合唯一の立体異性体のみが高い活性を持つので、昆虫フェロモンの不斉有機合成に関する研究がさかんに行なわれている。 多くの鱗翅目昆虫の雌に対する性フェロモンでは、cis(meso)-エポキシ環を有する化合物が非常に多く使われている。Brevetと森1)は、gypsy moth(マイマイ蛾)の性フェロモンであるdisparlure、及びruby tiger蛾のフェロモンなどの光学活性体への合成において、cis-2-butene-1,4-diolを出発物質とする合成法を確立したが、その中で不斉性導入の鍵となる、1,4-diacetoxy-cis-2,3-epoxybutaneから(2S,3R)-4-acetoxy-2,3-epoxybutan-1-olのような光学活性モノエステルへの加水分解反応(*)において、ブタ膵臓由来のリパーゼを用いることにより、最大約90%の光学純度(%e.e.)を得ることができた。 本研究では、この1,4-diacetoxy-cis-2,3-epoxybutaneから(2S,3R)-4-acetoxy-2,3-epoxybutan-1-olへの加水分解反応において、微生物酵素を利用することで、安価により高い変換収率を得ることを目指し、微生物のスクリーニング、微生物の同定、酵素を大量生産するための精製方法の確立、酵素の特性、酵素の遺伝子のクローニング及び塩基配列の決定に関する研究を行った。 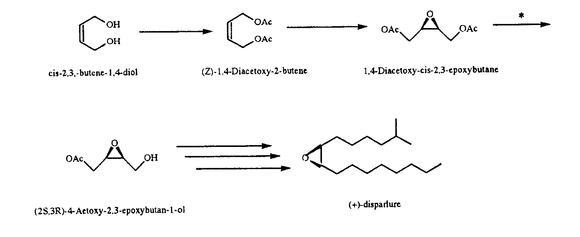 1.酵素生産菌株の分離及び同定 酵素生産菌株は東京近郊で採集した土壌から分離した。基質として用いた1,4-diacetoxy-cis-2,3-epoxybutaneは、Brevetらの方法に従いcis-2-butene-1,4-diolを出発物質として合成した。土壌から単離した約1000株の微生物について、細胞外画分(培地)、細胞内画分(超音波破砕上清)を基質と反応させ、薄層クロマトグラフィで展開してそれぞれの基質の変換活性を調べ、いくつかの標品に関して、生じた4-acetoxy-2,3-epoxybutane-1-olの光学活性を旋光計で測定した。 その結果、5株の細菌の生産する酵素が、1,4-diacetoxy-cis-2,3-epoxybutaneを70%以上の光学純度(%e.e.)を持つ4-acetoxy-2,3-epoxybutane-1-olに変換することが分かった。特にそのうち2株、HIM42とKSR24による産物は95-100%e.e.の光学純度を持つ(2S,3R)-4-acetoxy-2,3-epoxybutane-1-olであった。HIM42株はグラム陰性、運動性の桿菌である。KSR24株は生理試験、及び電子顕微鏡と光学顕微鏡を用いた形態的特徴の検討の結果、グラム陰性で運動性のあるわずかに湾曲した桿菌であり、極鞭毛を持っていた。また通性嫌気性であることからVibrio属と推測した。KSR24,HIM42両株の(2S,3R)-4-acetoxy-2,3-epoxybutane-1-olへの変換活性を持つ酵素は細胞外酵素であり、培養とともに細胞外へ分泌されることが明らかになった。 2.酵素の精製と性質 加水分解反応(*)の結果放出される酢酸を、酵素カップリング法で測定することにより本酵素の活性を定量化し、HIM42株,KSR24株からの細胞外酵素の精製を行った。しかしHIM42株酵素は1,4-diacetoxy-cis-2,3-epoxybutaneに対する光学純度は98-100%と高かったが、蛋白質が分解されやすいためかあるいは他の理由か不明だが、SDS-PAGEで分散した像を与えるのみで酵素の精製は困難であった。ただし本菌は培養液上清を用いても1,4-diacetoxy-cis-2,3-epoxybutaneに対し高い光学活性を示すことから、応用上は細胞の培養液を直接利用する方法も考えられる。 一方、KSR24株の酵素は、培養上清の50-80%飽和硫安沈澱、フェニルトヨパール、Q-セファロース、さらにMono-QとSuperdex200を用いたカラムクロマトグラフィーにより部分精製し、比活性は約93倍上昇した。SDS-PAGEによる推定分子量は約40,000であり、Superdex200ゲルろ過による推定分子量が120,000であることから、三量体酵素である可能性が考えられる。本酵素はp-nitropalmitateを基質としたリパーゼ活性を示さず、Tween20に対するエステラーゼ活性も示さないので、新しいタイプのエステラーゼである。非変性PAGEから抽出した精製酵素を1,4-diacetoxy-cis-2,3-epoxybutaneと反応させた時の純度は95%e.e.であり、Brevetらの用いたブタ膵臓リパーゼによる光学純度より高いことが分かり、以降本酵素の検討を進めた。なお、上記基質を用いて得られた本酵素の最適作用pHは7から8であった。 一方本酵素は、Ni,Ru,Agなどのキレート剤である1,10-フェナントロリン(1mM)によっては阻害されたが、EDTA(1mM)では阻害されなかった。HgCl2(1mM)で失活し、PCMB(1mM)やモノヨード酢酸(1mM)でも部分的失活が見られたので、活性保持に遊離SH基が関与している可能性がある。また、セリンプロテアーゼの阻害剤であるDFP(1mM)、PMSF(1mM)によって阻害を受けたので、活性中心の構造がセリンプロテアーゼに類似している可能性が考えられる。 3.遺伝子のクロニンーグ 精製したKSR24株の酵素を、Lys-C,V8,Asp-N,トリプシンの4種のプロテアーゼで部分分解し、N末端を含め合計10個のペプチド断片のN末端アミノ酸配列を決定した。このアミノ酸配列をもとに29組の、混合オリゴDNAプライマーを合成し、考えうる組合せすべてに関してPCR増幅を行った。その結果、別々のプライマーの組合せで、0.4kbp,0.5kbp,0.6kbpの3種の明瞭なPCR産物が得られた。それぞれのPCR産物をベクタープラスミドに挿入してプライマー近傍のDNA塩基配列を決定した結果、0.4kbpと0.6kbpの塩基配列は得られている部分アミノ酸配列と整合しなかったが、0.5kbpのPCR産物の塩基配列が部分アミノ酸配列と整合し、さらに別の断片の部分アミノ酸配列領域をも含んでいた。そこでこの0.5kbpのPCR産物をプローブとして遺伝子のクロニンーグを行った。種々の制限酵素で分解した染色体DNAのサザンハイブリダイゼーションの結果をもとにして、4.2kbpのHindIII断片をベクターpUC119のHindIII部位に連結し、大腸菌を形質転換してコロニーハイブリダイゼーションにより、約5000個のコロニーから13個の陽性クローンを取得した。このうちひとつの陽性クローンを選び、挿入断片の制限酵素マッピングとDNA塩基配列の決定を行っている。予備的実験ながら、本組換え体の菌体抽出液では、SDS-PAGEで推定分子量約40,000の蛋白質が新たに観察され、また大腸菌宿主の示すバックグラウンド活性に対し、70倍の酵素活性が測定されたので、求めるエステラーゼ遺伝子が得られていることが示唆された。 4.まとめ 土壌から分離した2菌株HIM42とKSR24が、1,4-diacetoxy-cis-2,3-epoxybutaneを光学純度95%e.e.以上のモノエステル(2S,3R)-4-acetoxy-2,3-epoxybutane-1-olへの加水分解する酵素を分泌することを明らかにした。KSR24菌株の酵素を精製してその特徴を明らかにし、それが新しいタイプのエステラーゼであることを示した。さらに酵素の部分アミノ酸配列情報をもとに遺伝子のクロニンーグを行った。 今後の展望としては、精製した酵素に対する基質としてスクリニンーグをすることにより、本酵素を新しい不斉変換反応に応用する可能性を。また、遺伝子の組み換え技術を応用することにより、大量発現系を構築すれば、さらに容易に大量の酵素を得ることができる。蛋白質工学的な遺伝子の改変により、1,4-diacetoxy-cis-2,3-epoxybutaneから光学活性モノエステルへの変換反応の光学純度及び収率の向上が期待される。 1)Brevet,J.-L.and Mori,K.;Synthesis,1992,1007. |