| 内容要旨 | | 緒言 タンパク質のフォールディング原理の解明は,分子生物学上重要な課題であり,実験・理論の両面から様々な解析がなされている.理論的な解析で重要な役割を果たすのは分配関数・自由エネルギーの計算であり,これまで様々な計算法が提案されてきた. 近年の酸・塩変性やアルコール変性などの実験から,タンパク質のフォールディングが溶媒や溶けているイオンの種類・量によって大きく変化することが明らかになっている.このことはタンパク質のフォールディングに溶媒の性質やイオンが大きく関与していることを示しており,理論によるタンパク質のフォールディング原理の解析には溶媒やイオンを考慮することが必要であることは明らかである.そこで本研究では,水・イオンを含めた系でのタンパク質のフォールディングの自由エネルギーを求めることを目的とした. 陽に水・イオンを含めた分配関数・自由エネルギー計算は,水・イオンの自由度が大きいために困難である.本研究ではPoisson-Boltzmann方程式の解をモンテカルロシミュレーション(MC),分子動力学計算(MD)に組み込む方法[1,2]を新たに開発して,水・イオンを含めた系でのフォールディングの自由エネルギー計算に用いた.Poisson-Boltzmann方程式を用いる方法は水・イオンの影響を平均的に与えることによってその自由度を減らす方法である.さらに,Poisson-Boltzmann方程式を用いることによって他の方法では考慮しにくいイオン強度や誘電率などの物理条件を考慮することが可能になった. 方法 Poisson-Boltzmann方程式とMC,MDを組み合わせる方法はこれまで数種類提案されているが,(1)イオンを含めることが困難である,(2)作用反作用の法則を満たさないためにMDには適さない,という問題があった.本研究で開発した方法は,一度Poisson-Boltzmann方程式を解きその解をqexp[- r]/r(rは原子からの距離)で近似できるとして電荷qを求める方法である.イオンからの寄与はexp[- r]/r(rは原子からの距離)で近似できるとして電荷qを求める方法である.イオンからの寄与はexp[- r]のなかに含められている.また,本研究ではエネルギーを求めてからその微分で力を求めているために,作用反作用の法則も満たされている. r]のなかに含められている.また,本研究ではエネルギーを求めてからその微分で力を求めているために,作用反作用の法則も満たされている. 本研究ではタンパク質のフォールディング自由エネルギーを求めるためにWeighted Histogram Analysis Method(WHAM)を採用した.WHAMを利用するために,構造を拘束したMC,MDを行うシステムを開発し,拘束箇所を変えた複数のシミュレーションを行った.拘束箇所を変えることにより,構造空間全体の自由エネルギー分布を計算することが可能になった.そのため,従来は困難であった水・イオンを含めた系での任意の構造間の自由エネルギー差を計算することが可能になった.また,各回のシミュレーションでは構造が拘束されているため,本研究で用いたPoisson-Boltzmann方程式の近似の精度も向上した. N-Acetyl-Alanyl-N-methylamideの構造 本研究で開発した方法をN-acetyl-alanyl-N-methylamide(アラニンジペプチド)の主鎖の二面角( , , )の自由エネルギー分布を求める問題に適用した.アラニンジペプチドはタンパク質と同様,主鎖構造を定める二面角 )の自由エネルギー分布を求める問題に適用した.アラニンジペプチドはタンパク質と同様,主鎖構造を定める二面角 , , を持つ最小の分子であり,タンパク質のフォールディングモデルとして広く用いられている. を持つ最小の分子であり,タンパク質のフォールディングモデルとして広く用いられている. 水中・メタノール中での主鎖の二面角 に関わるビシナルスピンスピン結合 に関わるビシナルスピンスピン結合 の計算値とNMRによる実測値を表1に示す.計算値は実験値と良い一致を示しており,本研究によるシミュレーションの結果が実在系を良く再現していることを示している. の計算値とNMRによる実測値を表1に示す.計算値は実験値と良い一致を示しており,本研究によるシミュレーションの結果が実在系を良く再現していることを示している.  表1:水中・メタノール中での 表1:水中・メタノール中での の値 の値 水分子を陽に取り扱う従来の計算では計算量が膨大になるために,事実上与えられた二つの構造間の自由エネルギー差を求めることしかできなかった.本研究では構造空間全体を計算しているため任意の構造間の自由エネルギー差を求めることができる.図1に本研究によって得られた( , , )平面上での自由エネルギー分布を示す.真空中に比べて水中では熱力学的に到達しやすい構造の範囲が広がっており,構造間を隔てるエネルギー障壁も小さくなっている.このことは,水中では真空中に比べて多様な構造をとることが可能であることを示している. )平面上での自由エネルギー分布を示す.真空中に比べて水中では熱力学的に到達しやすい構造の範囲が広がっており,構造間を隔てるエネルギー障壁も小さくなっている.このことは,水中では真空中に比べて多様な構造をとることが可能であることを示している. 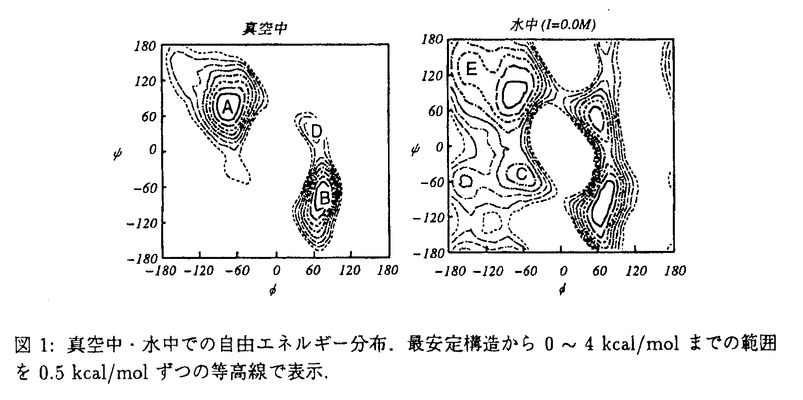 図1:真空中・水中での自由エネルギー分布.最安定構造から0〜4kcal/molまでの範囲を0.5kcal/molずつの等高線で表示. 図1:真空中・水中での自由エネルギー分布.最安定構造から0〜4kcal/molまでの範囲を0.5kcal/molずつの等高線で表示. 図1でのエネルギー極小構造間の自由エネルギー差,およびそれに対する水分子を陽に扱う従来の計算で求められた自由エネルギー差を表2に示す.両者はほぼ一致しており,このことは本研究で用いた方法は陽に水分子を扱う方法の近似として十分であることを示している.また,イオン強度Iを変化させた時の自由エネルギー差の変化は真空中と水中(I=0.0M)での自由エネルギー差の変化に比べて小さく,アラニンジペプチドの構造においてはイオンによる自由エネルギー分布に与える影響は大きなものではないことが明らかになった.  表2:エネルギー極小構造間の自由エネルギー差(kcal/mol)a:Anderson et al.,Proteins,1988,3,262-265 b:Tobias et al.,J.Phys.Chem,1992,96,3864-3870Ace-Ala-Ala-Ala-Nmeの水素結合間距離 表2:エネルギー極小構造間の自由エネルギー差(kcal/mol)a:Anderson et al.,Proteins,1988,3,262-265 b:Tobias et al.,J.Phys.Chem,1992,96,3864-3870Ace-Ala-Ala-Ala-Nmeの水素結合間距離  -ヘリックスはタンパク質のフォールディングの初期の段階で形成されるといわれており,その形成機構を解析することはタンパク質のフォールディング機構の解明に有用な示唆を与えるものと考えられる.アミド基NHとカルボニル基C=Oとの水素結合が -ヘリックスはタンパク質のフォールディングの初期の段階で形成されるといわれており,その形成機構を解析することはタンパク質のフォールディング機構の解明に有用な示唆を与えるものと考えられる.アミド基NHとカルボニル基C=Oとの水素結合が -ヘリックスを特徴付けるため,この両者間の距離に対する自由エネルギー分布を求めた.対象としては,従来から -ヘリックスを特徴付けるため,この両者間の距離に対する自由エネルギー分布を求めた.対象としては,従来から -ヘリックスのモデル分子として用いられているAce-(Ala)3-Nmeを選んだ.この分子の両端のカルボニル基とアミド基との間の距離 -ヘリックスのモデル分子として用いられているAce-(Ala)3-Nmeを選んだ.この分子の両端のカルボニル基とアミド基との間の距離 に対する自由エネルギー分布を真空中・水中(イオン強度I=0.0,0.1,0.3M)について求めたものを図2に示す. に対する自由エネルギー分布を真空中・水中(イオン強度I=0.0,0.1,0.3M)について求めたものを図2に示す. 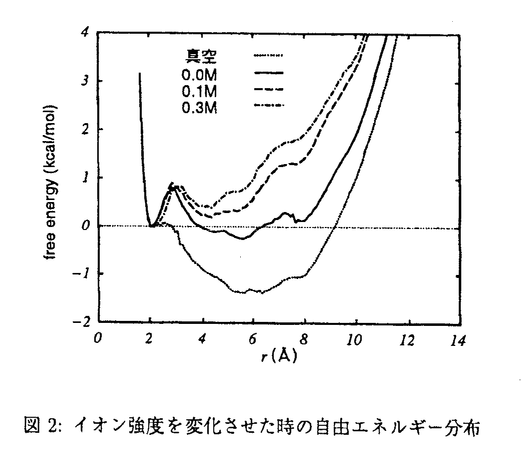 図2:イオン強度を変化させた時の自由エネルギー分布 図2:イオン強度を変化させた時の自由エネルギー分布 真空中でのエネルギー分布に比べて水中では <3Aの領域が安定な領域として存在している.この結果は水がヘリツクス状態を安定化していることを示す.イオン強度を高めると, <3Aの領域が安定な領域として存在している.この結果は水がヘリツクス状態を安定化していることを示す.イオン強度を高めると, >3Aの領域が不安定化され,イオン強度が0.0Mの時には存在していた >3Aの領域が不安定化され,イオン強度が0.0Mの時には存在していた 〜8A付近の極小点が消滅している.この結果はイオン強度を上げると,伸びた状態よりも 〜8A付近の極小点が消滅している.この結果はイオン強度を上げると,伸びた状態よりも -ヘリックス状態の方が安定になることを示している.塩を水溶液中に溶かすことにより,一度アンフォールドしたペプチドがヘリックス状態になるという実験事実が報告されており,本研究で得られた結果はその実験事実に対応するものと考えられる. -ヘリックス状態の方が安定になることを示している.塩を水溶液中に溶かすことにより,一度アンフォールドしたペプチドがヘリックス状態になるという実験事実が報告されており,本研究で得られた結果はその実験事実に対応するものと考えられる. ヘリックス状態と非ヘリックス状態間の熱力学量を示したものが表3である.ヘリックス状態は自由エネルギーからみると不安定である.しかし内部エネルギーはヘリックス状態のほうが安定であり,ヘリックス状態はエントロピーによって不安定化されていることが明らかになった.またアラニンジペプチドの場合とは異なり,イオン強度がヘリックス傾向に大きく影響することが明らかになった.さらにその主要因は内部エネルギーであり,エントロピー効果は小さいことが明らかになった.  表3:温度300Kにおけるヘリックス状態との間の自由エネルギー( 表3:温度300Kにおけるヘリックス状態との間の自由エネルギー( A),内部エネルギー( A),内部エネルギー( U),構造エントロピー(-T U),構造エントロピー(-T Scon fig).単位は全てkcal/mol.結論 Scon fig).単位は全てkcal/mol.結論 以上,本研究ではPoisson-Boltzmann方程式の解をMC,MDの中に組み込む方法を開発し,それを自由エネルギー分布の計算に応用した.その結果,アラニンジペプチドに対しては(1) パラメータの値が実験値と一致する,(2)溶媒は熱力学的に到達可能な構造の幅を広くしている,(3)構造間の自由エネルギー差は水分子を陽に含める従来の計算とほぼ一致する,という結果を得た.これらの結果は,本研究で開発したPoisson-Boltzmann方程式を用いたMD,MCにより得られる構造群が現実の系を表しており,また,従来の陽に水分子を含める計算の近似としても十分な精度を持っていることを示している.Ace-(Ala)3-Nmeの水素結合距離に対する解析では水・イオンともに パラメータの値が実験値と一致する,(2)溶媒は熱力学的に到達可能な構造の幅を広くしている,(3)構造間の自由エネルギー差は水分子を陽に含める従来の計算とほぼ一致する,という結果を得た.これらの結果は,本研究で開発したPoisson-Boltzmann方程式を用いたMD,MCにより得られる構造群が現実の系を表しており,また,従来の陽に水分子を含める計算の近似としても十分な精度を持っていることを示している.Ace-(Ala)3-Nmeの水素結合距離に対する解析では水・イオンともに -ヘリックス状態を安定化することが明らかになった.イオンによる -ヘリックス状態を安定化することが明らかになった.イオンによる -ヘリックスの安定化は実験からも明らかにされてきており,本研究による結果はイオンによる -ヘリックスの安定化は実験からも明らかにされてきており,本研究による結果はイオンによる -ヘリックスの安定化はPoisson-Boltzmann方程式から説明がつくものであることを示している. -ヘリックスの安定化はPoisson-Boltzmann方程式から説明がつくものであることを示している. 本研究で開発された方法は,構造空間を広く探索しつつ溶媒の効果を計算できる.そのため,フォールディング状態からアンフォールディング状態までの幅広い範囲の自由エネルギー差を求めることが可能であり,タンパク質のフォールディング機構の解明に役立つものと考えられる. [1] Koichi Tazaki and Junta Doi,J.Phys, Chem,1996,100,14520-14525[2]Koichi Tazaki and Kentaro Shimizu,J.Phys.Chem,submitted |
| 審査要旨 | | タンパク質のフォールディング原理の解明は、分子生物学上重要な課題であり、実験・理論の両面から様々な解析がなされている。理論的な解析で重要な役割を果たすのは分配関数・自由エネルギーの計算であり、これまで様々な計算法が提案されてきた。 本論文では、タンパク質のフォールディング原理を探索するために、ポアソン・ボルツマン方程式と分子動力学計算を組み合わせる新しい方法を開発し、自由エネルギー計算に用いている。そして、タンパク質のフォールディングの解析の例として、 ヘリックスの構造解析を行っている。 ヘリックスの構造解析を行っている。 第1章の緒論では、まず、タンパク質のフォールディングの解析には自由エネルギーが重要であることを述べている。そして、酸・塩変性やアルコール変性などの実験をもとに溶媒がタンパク質のフォールディングに大きく関わっていることを述べ、フォールディングを考える上で溶媒からの寄与が重要であることを述べている。 第2章では、フォールディング解析を行う上での理論的背景を述べている。自由エネルギーを求めるための分配関数の統計的推測については、分子動力学計算が統計的な標本抽出にあたることを述べている。また、標本抽出という観点から、正しく溶媒からの寄与を得るための方法(平均場)について述べた後に、ポアソン・ボルツマン方程式の位置づけを述べている。最後に、ポアソン・ボルツマン方程式と分子動力学計算を組み合わせた従来の研究を概観している。 第3章では、フォールディング解析を行う際に用いた方法の説明を行っている。本論文で独創的な点は第3節で述べられているポアソン・ボルツマン方程式と分子動力学法を融合させる方法である。この方法は、三つの部分からなる。一つは、一度ポアソン・ボルツマン方程式を解いた後に、本来は空間的には一様でない系を、仮想的に溶媒と同じ条件で空間的に一様であるとみなす部分である。二つめは、その様な仮想的な系において既に解いてあるポアソン・ボルツマン方程武の解を再現する実効的な電荷を求める部分である。三つめは実効的な電荷から溶媒との相互作用をエネルギーの形で求める部分である。この方法は、系全体を溶媒と同じ条件で空間的に一様であるとみなし、溶媒との相互作用をエネルギーの形で求めているために、作用反作用の法則を満たしつつ、イオンからの寄与を容易に求められる方法となっており、独創的なものである。 第4章では、静的な系での検証、アラニンジペプチドをテスト分子に用いた動的な系での検証、そしてモデルヘリックスでの様々な解析を行っている。 静的な系での検証では、格子誤差と、ポアソン・ボルツマン方程式の解のエネルギーという観点からの再現性を評価している。 アラニンジペプチドによる検証では、様々な高い誘電率を持つ溶媒中でのスピンスピン結合のカップリングパラメータの実測値を再現している。また、従来の自由エネルギー計算とも一致する結果を示している。これらのことから、本論文で新たに開発した方法が十分な精度を持っていることを示している。 モデルヘリックスの水素結合距離に対する解析では水・イオンともに -ヘリックス状態を安定化することを明らかにしている。水による -ヘリックス状態を安定化することを明らかにしている。水による -ヘリックス状態の安定化は極性原子の溶媒露出表面積と電気双極子モーメントが重要な役割を果たしていることを示している。また、実験から示されているイオンによる -ヘリックス状態の安定化は極性原子の溶媒露出表面積と電気双極子モーメントが重要な役割を果たしていることを示している。また、実験から示されているイオンによる -ヘリックス状態の安定化はポアソン・ボルツマン方程式から説明がつくものであると結論している。一方、実験から示されているアルコールによる -ヘリックス状態の安定化はポアソン・ボルツマン方程式から説明がつくものであると結論している。一方、実験から示されているアルコールによる -ヘリックス状態の安定化は、誘電率の変化に対する -ヘリックス状態の安定化は、誘電率の変化に対する -ヘリックス状態の自由エネルギー変化の解析から、非静電的効果に起因すると結論している。また、水分子の座標を陽に計算する方法では、時間がかかる上に統計的な精度も低いことを示している。 -ヘリックス状態の自由エネルギー変化の解析から、非静電的効果に起因すると結論している。また、水分子の座標を陽に計算する方法では、時間がかかる上に統計的な精度も低いことを示している。 第5章では、まとめとして本論文で使用したシステムを述べ、その後に、第4章で得られた結論をまとめている。 以上、本論文ではポアソン・ボルツマン方程式と分子動力学計算を融合させる独創的な方法を開発し、 -ヘリックス形成の自由エネルギー計算に適用し、実験から得られている現象に対する理論的な解釈を与えている。本研究は学術上、応用上、寄与するところが少なくない。よって、審査委員一同は、本論文が博士(農学)の学位論文として価値あるものと認めた。 -ヘリックス形成の自由エネルギー計算に適用し、実験から得られている現象に対する理論的な解釈を与えている。本研究は学術上、応用上、寄与するところが少なくない。よって、審査委員一同は、本論文が博士(農学)の学位論文として価値あるものと認めた。 |