学位論文要旨
| No | 112745 | |
| 著者(漢字) | 本田,啓 | |
| 著者(英字) | ||
| 著者(カナ) | ホンダ,アキラ | |
| 標題(和) | 分裂酵母のトリコスタチンA耐性遺伝子とその機能に関する研究 | |
| 標題(洋) | ||
| 報告番号 | 112745 | |
| 報告番号 | 甲12745 | |
| 学位授与日 | 1997.03.28 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(農学) | |
| 学位記番号 | 博農第1808号 | |
| 研究科 | 農学生命科学研究科 | |
| 専攻 | 応用生命工学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | 真核生物の遺伝子はDNAがコアヒストンに巻き付いたヌクレオソームを基本単位とし、それらが複雑に高次構造を形成した、いわゆるクロマチン構造をとっている。従って遺伝子発現制御を考えた場合、原核生物のような単純な制御だけでなく、クロマチン構造の立体的な制御も考慮する必要がある。このような高次構造制御を担うもののうち最も重要なものとしてコアヒストンのアセチル化が知られている。ヒストンN末領域のリジン残基で起こるアセチル化が細胞周期進行や分化の過程で時期特異的に発現される遺伝子の転写開始の際に時期特異的に特定のクロマチン領域で起こること、酵母のmating lociやテロメア領域近傍のいわゆるサイレンシング領域と呼ばれる領域のヒストンのアセチル化がほとんど起こっていないことなどから、真核細胞における転写開始の必要条件であると考えられている。すなわち細胞内外からの情報がシグナル伝達によって核内に伝えられたのち、転写因子の活性化とともにヒストンのアセチル化が領域特異的な転写開始を決めるのではないかと推定される。しかし、アセチル化のレベルを決定するアセチル化酵素と脱アセチル化酵素の精製、遺伝子のクローン化はともに最近になるまで成功していなかったため、その詳細はほとんど明らかになっていない。 一方、醗酵学研究室においてマウスフレンド白血病細胞の強力な分化誘導物質として再発見されたトリコスタチンA(TSA)は、ラット正常繊維芽細胞3Y1をG1、G2両期で可逆的に停止させる特異的細胞周期阻害剤であり、その一次標的分子がヒストン脱アセチル化酵素であることが示されてきた。本研究は、ヒストン脱アセチル化酵素阻害剤TSAの分裂酵母に対する作用を解析し、さらに分子遺伝学的手法を用いて分裂酵母のTSA耐性遺伝子の取得とその機能に関する解析を行うことにより、ヒストンアセチル化制御機構を解明することを目的とする。 TSAは低濃度で様々な動物細胞に対して細胞周期のG1、G2両期での可逆的な停止や分化の誘導、細胞形態の正常化といった変化を引き起こすことが明らかとなっている。そこで、TSAを野生株分裂酵母Schizosaccharomyces pombeに対して作用させ、増殖の様子を寒天培地と液体培地で観察した。ところが、動物細胞の場合と異なり、寒天培地上では培地中に溶かしうる最大濃度(50 以上の結果より、TSAを分裂酵母に対して処理することにより細胞周期の停止は引き起こさないものの、新たな蛋白質合成に伴う細胞の凝集や酸性フォスファターゼの誘導、接合及び胞子形成能の低下といった様々な表現型の変化を引き起こすことが明らかとなった。TSAはin vitroで分裂酵母のヒストン脱アセチル化酵素を阻害することから、これらの表現型の変化はヒストン脱アセチル化酵素の阻害の結果引き起こされたものであると考えられる。 先に述べたように分裂酵母に対してTSA処理を行っても増殖の阻害が見られなかった。このことは、薬剤の透過性が悪いことに加えて動物細胞に比べて分裂酵母のヒストン脱アセチル化酵素のTSA感受性が低いことに起因している可能性が強く示唆される。そこで変異処理により感受性が上昇すれば、増殖阻害が観察でき、さらにこの感受性を相補する遺伝子をクローニングする事によりヒストンアセチル化酵素及びその制御因子を取得することができると考えた。野生株S.pombeをEMS変異処理し、26.5℃でTSA感受性を示す変異株をスクリーニングした。その結果、約1×108の頻度で許容温度下で目的の形質を有する変異株を1株(tss1)取得した。tss1株はTSA5 tss1株のTSA感受性が劣性であったことから、TSA耐性の賦与を指標に、S.pombe野生株の染色体DNAより作成したゲノムライブラリーを用いてtss1株を形質転換し、TSAに対する耐性を野生株並にまで上昇した形質転換体を計6株取得した。各々からプラスミドの単離を試みたところ、4株のプラスミド(pTSR2,pTSR5,pTSR13,pTSR32)は回収できたが、残る2株(TSR4,TSR11)の回収ができなかった。そこで、各株をcuringし、得られた形質がプラスミド由来であるかを確認したところ、TSR4株を除いて全ての株がプラスミド由来であることが判明した。従ってTSR4株はプラスミドが宿主染色体DNAに挿入されたこと、TSR11株は何らかの理由により酵母細胞内でプラスミドの部分的欠落が起こり大腸菌のoriを失ったことが判明した。回収できたプラスミドの制限酵素地図を比較したところ、3種(pTSR2,pTSR5,pTSR13)がオーバーラップしていた。 3種のプラスミドでオーバーラップしていたtsr1を含むプラスミドpTSR5について必須領域のサブクローニングと塩基配列の決定を行った。その結果、tsr1は497アミノ酸残基からなる新規の蛋白質をコードしていることがわかった。ホモロジー検索を行ったところ、特に高い相同性を持つ蛋白質は存在せず、機能の推定はできなかった。本遺伝子を多コピーで導入されたS.pombe感受性株tss1は、TSAとトラポキシン以外の他の薬剤に対して感受性が変化しなかった。現在、遺伝子破壊株の構築などの遺伝学的解析と、遺伝子産物に対する生化学的解析を行っているところである。 tsr2遺伝子を含むプラスミドpTSR32について必須領域をサブクローニングし、塩基配列を決定した。その結果、tsr2は3つのイントロンを有する4つのエクソンに別れており、322アミノ酸残基からなる蛋白質をコードしていることがわかった。ホモロジー検索の結果、本遺伝子産物は、分裂酵母の細胞周期のM期進行に関与しているdis2遺伝子の変異株のサプレッサーとして京都大学理学部の柳田らによりS.pombeからクローン化されたタイプ1フォスファターゼsds21+と完全に一致した。本遺伝子は、柳田らの研究により必須遺伝子ではないこと、dis2遺伝子産物とともに細胞周期のM期進行に関与しているらしいことが明らかとなっている。 1996年に入り、アメリカのS.Schreiberらによりトラポキシン結合蛋白質としてヒトからヒストン脱アセチル化酵素遺伝子Hd1がクローン化された。この遺伝子は、出芽酵母の転写制御因子であるRPD3と相同性があり、RPD3遺伝子産物にヒストン脱アセチル化酵素活性があることが示された。そこで、分裂酵母におけるRPD3ホモログ遺伝子をクローン化を行った。HD1とRPD3間で高く保存されている領域を利用してランダムプライマーを作製し、分裂酵母のゲノムを鋳型としてPCRを行い、単一のバンドを取得した。このDNAをプローブとして定法に従いRPD3ホモログ遺伝子全長を取得し、塩基配列を決定した。本遺伝子は434アミノ酸からなる蛋白質をコードしており、HD1と58%の相同性、76%の類似性を示した。この遺伝子をマルチコピープラスミドでtss1株に導入したところ、約4倍のTSA耐性を賦与した。本遺伝子の破壊株は、TSAに対して感受性を示さなかったが、DNA合成阻害剤ハイドロキシウレア及び各種イオンストレスに対する感受性が上昇し、また接合及び胞子形成能が欠損していた。 本研究では、まず分裂酵母に対するTSAの作用を検討し、増殖の停止は引き起こさないものの、液体培養時の細胞の凝集や接合及び胞子形成能の低下、酸性フォスファターゼの誘導など様々な形質の変化が現れることを明らかにした。蛋白質合成阻害剤との共存実験により、その形質の変化がTSA処理によって起こる新たな遺伝子発現の結果生じたものであることが強く示唆された。 本研究で取得されたTSA感受性変異株はTSAとトラポキシンという2種のヒストン脱アセチル化酵素にのみ感受性を示したことから、この変異遺伝子がヒストンアセチル化制御因子であることが強く示唆されるが、野生株の染色体DNAのゲノムライブラリーを用いたクローニングでは現在までのところ、変異遺伝子の取得を確認するまでにはいたっていない。しかし、本研究で取得したtsr1遺伝子及びsds21遺伝子はマルチコピーによってTSAとトラポキシンに対してのみ耐性を賦与することから、これらの遺伝子はヒストンアセチル化を制御する因子の一つである可能性が高い。 本研究において出芽酵母RPD3遺伝子のホモログとして取得したrpd3+遺伝子が感受性株にTSA耐性を賦与したことから、本遺伝子は分裂酵母のヒストン脱アセチル化酵素活性を有している可能性が高いと考えられる。本遺伝子破壊株はTSA感受性を示さなかったが、ヒストン脱アセチル化酵素は複数存在していると考えられていることから、他の遺伝子産物が活性を相補していることも考えられる。また、rpd3破壊株がハイドロキシウレア感受性と接合・胞子形成欠損の形質を示したことから、Rpd3遺伝子産物が細胞周期のチェックポイントや接合及び胞子形成の過程に必須である可能性が強く示唆される。 以上のように、分裂酵母のTSA感受性変異株を利用してヒストンアセチル化制御因子が実際に取得可能であることが示された。このように本研究はヒストンの脱アセチル化酵素阻害剤を用いて、ヒストン脱アセチル化に関わる制御に新しい知見をもたらすとともに、今回取得されたTsr1、Sds21、Rpd3の機能解析の研究を通じて、分裂酵母におけるヒストンのアセチル化/脱アセチル化を介した遺伝子発現制御機構を解明する一歩となるものである。 | |
| 審査要旨 | トリコスタチンA(TSA)は、様々な細胞に細胞周期の停止と分化を引き起こす放線菌代謝産物であり、その一次標的分子がヒストン脱アセチル化酵素であることが示されている。本研究は、TSAの分裂酵母Schizosaccharomyces pombeに対する作用を解析し、さらに分子遺伝学的手法を用いて分裂酵母のTSA耐性遺伝子の取得とその機能に関する解析を行うことにより、ヒストンアセチル化制御機構の一端を解明したものである。 寒天培地上では生育の阻害が見られないTSAの分裂酵母に対する作用を液体培地中で観察したところ、細胞の増殖のTSA濃度依存的な遅延が観察された。その時の細胞の様子を顕微鏡観察したところ、TSA処理した細胞は処理していない細胞に比べて細胞の伸長及び肥大化が生じ、さらにTSA濃度依存的な細胞の凝集が観察された。次にリン酸欠乏時に誘導されることが知られている酸性フォスファターゼの活性のTSA処理による変化を観察したところ、非誘導条件下でTSA濃度依存的に活性が上昇した。細胞の凝集と酸性フォスファターゼの活性は蛋白質合成阻害剤シクロヘキシミドを共存させることで観察されなくなったことから、TSA処理によるこれらの現象は新たな蛋白質合成に伴うものであることが示された。続いて接合、胞子形成能に与える影響について検討した。TSA処理により低濃度(5 TSA処理により様々な形質の変化が観察されるにもかかわらず、生育の阻害が認められないことから、分裂酵母には複数のヒストン脱アセチル化酵素が存在し、かつTSA耐性の酵素が存在する可能性が考えられた。そこで、分裂酵母野生株972に変異処理を行い、TSAに感受性を示す変異株の取得を試みた。その結果、通常培養温度でTSAに野生株の20倍以上の感受性を示す株を1株(TSS1)取得した。この変異株はもう一つのヒストン脱アセチル化酵素阻害剤であるトラポキシンにのみ感受性を示したことから、この変異株に生じた変異はヒストン脱アセチル化酸素そのもの、あるいはヒストンアセチル化制御に関与する遺伝子の変異である可能性が高いと考えられた。TSS1株の変異は劣性であることが明らかとなったが、四分子解析により、TSS1株の変異が1つではなく、致死性を与える変異とその致死性をサプレスする変異の二重変異であり、これら2つの変異が共存してTSA感受性を示すことが明らかとなった。従って、本変異株の原因遺伝子を特定することは困難となったが、TSA耐性賦与を指標としたヒストンアセチル化制御因子のクローニングのための良い受容菌であると考え、以後のクローニングに用いることとした。 TSS1株へのTSA耐性賦与を指標にS.pombe野生株の染色体DNAより作成したゲノムライブラリーを用いてTSS1株を形質転換し、TSAに対する耐性が野生株並にまで上昇した形質転換体を計6株取得した。各々からプラスミドの単離を試みたところ、4株のプラスミドを回収し、制限酵素地図を比較した。その結果、3種がオーバーラップしていた。 3種のプラスミドでオーバーラップしていた必須領域の塩基配列を決定したところ、497アミノ酸残基からなる新規の蛋白質(tsr1)をコードしていることが明らかとなった。ホモロジー検索の結果、特に高い相同性を持つ蛋白質は存在せず、機能の推定は出来なかった。本遺伝子を多コピーで導入されたTSS1株はTSAとトラポキシン以外の薬剤に対して感受性が変化しなかった。このことから、本遺伝子産物がヒストンアセチル化制御因子のひとつであると考えられる。 tsr2伝子を含む遺伝子の必須領域をサプクローニングし塩基配列を決定した。その結果、tsr2は3つのイントロンを有している322アミノ酸残基からなる蛋白質をコードしていることが明らかとなった。ホモロジー検索の結果、本遺伝子産物は分裂酵母の細胞周期のM期進行に関与しているdis2遺伝子の低温感受性変異株のサプレッサーとして京都大学理学部の柳田らによりS.pombeからクローン化されたタイプ1フォスファターゼsds21+と完全に一致した。本遺伝子は、柳田らの研究により、必須遺伝子ではないこと、dis2遺伝子産物とともに細胞周期のM期進行に関与しているらしいことが明らかとなっている。 1996年に入り、アメリカのS.Schreiberらによりトラポキシン結合蛋白質としてヒトからヒストン脱アセチル化酵素遺伝子Hd1がクローン化された。この遺伝子は出芽酵母の転写制御因子であるRPD3と相同性があり、RPD3遺伝子産物にヒストン脱アセチル化酵素活性があることが示された。そこで、分裂酵母におけるRPD3ホモログ遺伝子のクローン化を行い、RPD3ホモログ遺伝子全長の取得、塩基配列の決定を行った。本遺伝子は434アミノ酸からなる蛋白質をコードしており、HD1と58%の相同性、76%の類似性を示した。この遺伝子を多コピーでTSA感受性TSS1に導入したところ、約4倍のTSA耐性を賦与した。本遺伝子の破壊株は、TSAに対して感受性を示さなかったが、各種イオンストレスに対する感受性が上昇し、また接合及び胞子形成能が欠損していた。このことから、本遺伝子は分裂酵母におけるヒストン脱アセチル化酵素である可能性が高いと考えられる。 以上本研究は、分裂酵母のTSA感受性変異株を利用してヒストンアセチル化制御因子を取得し、分裂酵母におけるヒストン脱アセチル化に関わる制御に新しい知見をもたらしたとともに、今回取得された遺伝子産物の機能解析の研究を通じて、分裂酵母におけるヒストンのアセチル化/脱アセチル化を介した遺伝子発現制御機構を解明する一歩となるものである。 よって、審査委員一同は、本論文が博士(農学)の学位論文として価値あるものと認めた。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54587 |
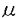 g/ml)のTSAを作用させても増殖の阻害が見られなかった。液体培養時においては、定常期の菌濃度がTSA濃度依存的に低下することが観察されたものの、顕著な細胞周期の停止は見られなかった。一方、TSAによりいくつかの形質の変化が観察された。第一に液体培養時における細胞の凝集であり、TSA5
g/ml)のTSAを作用させても増殖の阻害が見られなかった。液体培養時においては、定常期の菌濃度がTSA濃度依存的に低下することが観察されたものの、顕著な細胞周期の停止は見られなかった。一方、TSAによりいくつかの形質の変化が観察された。第一に液体培養時における細胞の凝集であり、TSA5