Thermococcus litoralisは嫌気性のHyperthermophilic archaea(超好熱性古細菌あるいは始原菌)の一つで、Thermococalesに属する。本菌の形態は不規則な球状で、大きさは0.5〜3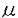 mで、鞭毛はない。この菌の生育最適温度は85℃、生育温度範囲は55〜98℃である。そして、生育最適pHは6.0、生育pH範囲は4.4〜8.0である。最適な塩(NaCl)の濃度は3.0%で、塩濃度の範囲は1.8〜6.5%である。そして、ペプトンなどのペプチド系栄養源を用いて良好な生育を示すほか、デンプンやマルトースを炭素源としても生育することができる。そして、DNAのG+C含量は38%である。 mで、鞭毛はない。この菌の生育最適温度は85℃、生育温度範囲は55〜98℃である。そして、生育最適pHは6.0、生育pH範囲は4.4〜8.0である。最適な塩(NaCl)の濃度は3.0%で、塩濃度の範囲は1.8〜6.5%である。そして、ペプトンなどのペプチド系栄養源を用いて良好な生育を示すほか、デンプンやマルトースを炭素源としても生育することができる。そして、DNAのG+C含量は38%である。 本研究においては、まず本菌の菌体抽出粗酵素液中に、マルトトリオースを基質として、単糖から七単糖以上のオリゴ糖を生成する糖転移活性をもつ4- -グルカノトランスフェラーゼを見いだし、この酵素を精製し、その性質を明らかにした。本酵素のN末端アミノ酸配列を決定し、これを基にオリゴヌクレオチドを合成し、これをプローブとして酵素遺伝子をクローニングし、塩基配列の決定を行い、大腸菌での発現系を構築した。また、本酵素の反応生成物中に環状 -グルカノトランスフェラーゼを見いだし、この酵素を精製し、その性質を明らかにした。本酵素のN末端アミノ酸配列を決定し、これを基にオリゴヌクレオチドを合成し、これをプローブとして酵素遺伝子をクローニングし、塩基配列の決定を行い、大腸菌での発現系を構築した。また、本酵素の反応生成物中に環状 -1,4-グルカン(サイクロアミロース)を見いだした。そして、本酵素を大腸菌で大量発現させ、本酵素蛋白質の結晶化に成功した。 -1,4-グルカン(サイクロアミロース)を見いだした。そして、本酵素を大腸菌で大量発現させ、本酵素蛋白質の結晶化に成功した。 第1章4- -グルカノトランスフェラーゼの精製と性質 -グルカノトランスフェラーゼの精製と性質 嫌気的条件下、85℃で培養したT.litoralis菌体中に、マルトース以上のマルトオリゴ糖を基質とする、糖転移活性を持つ酵素を見いだした。本酵素反応において、マルトペンタオース以上のマルトオリゴ糖を基質とした場合、興味あることに、薄層クロマトグラフィーの原点に留まる長い糖鎖が生成していることが認められた。後に述べるように、本酵素は4- -グルカノトランスフェラーゼであることが分かった。本酵素活性の測定は、便宜的に、遊離するグルコース量の測定により行った。 -グルカノトランスフェラーゼであることが分かった。本酵素活性の測定は、便宜的に、遊離するグルコース量の測定により行った。 4- -グルカノトランスフェラーゼの精製は、T.litoralis菌体を超音波処理で破砕した菌体抽出液の70%飽和硫安沈殿画分から出発し、DEAEセファロース、ブチルトヨパール、さらにMono QとSuperose 12を用いたカラムクロマトグラフィーにより行った。最終的に得られた本酵素の精製標品は比活性で約78倍上昇し、SDS-PAGE上で分子量約85,000の単一バンドを示した。Superose 12を用いたゲルろ過の結果から推定される分子量は約87,000であり、単量体酵素であると考えられる。本酵素の糖転移活性の最適pHは6.0、活性のpH範囲は5.5〜10.0である。本酵素反応の最適温度は90℃であり、酵素の耐熱性は高く、90℃に3時間おいても活性は変わらなかった。そして、95℃で30min保温後も84%の残存活性を示した。これらの結果から本酵素は高い耐熱性をもつ酵素であることが明らかになった。 -グルカノトランスフェラーゼの精製は、T.litoralis菌体を超音波処理で破砕した菌体抽出液の70%飽和硫安沈殿画分から出発し、DEAEセファロース、ブチルトヨパール、さらにMono QとSuperose 12を用いたカラムクロマトグラフィーにより行った。最終的に得られた本酵素の精製標品は比活性で約78倍上昇し、SDS-PAGE上で分子量約85,000の単一バンドを示した。Superose 12を用いたゲルろ過の結果から推定される分子量は約87,000であり、単量体酵素であると考えられる。本酵素の糖転移活性の最適pHは6.0、活性のpH範囲は5.5〜10.0である。本酵素反応の最適温度は90℃であり、酵素の耐熱性は高く、90℃に3時間おいても活性は変わらなかった。そして、95℃で30min保温後も84%の残存活性を示した。これらの結果から本酵素は高い耐熱性をもつ酵素であることが明らかになった。 一方、本酵素は、1,10-フェナントロリン(10mM)のような金属キレート剤によって約50%阻害された。システイン修飾試薬のモノヨード酢酸(10mM)、p-クロロメルクリ安息香酸(10mM)により活性は強く阻害された。 第2章4- -グルカノトランスフェラーゼの遺伝子のクローニングと塩基配列の決定、酵素のアミノ酸配列の特徴 -グルカノトランスフェラーゼの遺伝子のクローニングと塩基配列の決定、酵素のアミノ酸配列の特徴 本酵素のN末端アミノ酸配列を決定し、得られた配列をもとにオリゴDNAを合成し、クローニングプローブとして使用した。T.litoralisのDNAを種々の制限酵素で切断し、サザンハイブリダイゼーションを行ったところ、合成プローブはHindIIIの約3.6kbpのDNA断片とハイブリッドを形成した。そこで3.6kbp近傍のDNA断片をアガロースゲルから回収し、プラスミド・ベクターpUC119のHindIII部位に挿入し、大腸菌MV1184株を形質転換してコロニーハイブリダイゼーションを行った。その結果、得られた約1,000個のコロニー中で10個の陽性クローンが得られ、これらの陽性クローンから抽出したプラスミドは合成したプローブとハイブリッドを形成した。これらのクローン断片に対する各種の制限酵素によるマッピングを行った結果、10個の陽性クローンは同一のものであった。 クローニングされたDNA断片の塩基配列を決定した結果、ATGの開始コドンとTGAの終止コドンを持つ1,980bpからなるOpen reading frame(ORF)が存在し、最初の19残基までのアミノ酸配列は蛋白質の精製標品を用いて決定したN末端アミノ酸配列と同一であることが確認された。5’-非翻訳領域にはTATAボックスに類似した古細菌特有の転写開始配列Box Aとリボソーム結合配列(RBS)が存在した。3’-非翻訳領域にはTGAの終止コドンに続いて古細菌で特徴的なT-rich terminal signal(TTTCTTTT)が認められた。ORFのアミノ酸配列から、本酵素は659アミノ酸残基からなる、分子量77,883の蛋白質であることが分かった。また本酵素遺伝子のGC含量は44.2%であった。 本酵素のアミノ酸配列は超好熱性古細菌Pyrococcus furiosusならびに嫌気性高度好熱性細菌Dictyoglomus thermophilumの -アミラーゼのものと、それぞれ65%、42%の高い相同性を示した。しかし、本酵素にはアミラーゼ活性は認められなかった。 -アミラーゼのものと、それぞれ65%、42%の高い相同性を示した。しかし、本酵素にはアミラーゼ活性は認められなかった。 第3章大腸菌での本酵素遺伝子の大量発現と酵素精製 本酵素遺伝子を含む2.6kbpのHindIII-SmaI DNA断片をpUC119にサブクローニングし、プラスミドpJGT2(5.8kbp)を作った。部位特異的変異により、lacZの開始コドンATGと本酵素遺伝子(開始コドンATGを除く)とを融合させ、プラスミドpJGT3(5.4kbp)を構築し、大腸菌での発現系を確立した。 pJGT3を持つ大腸菌MV1184を3ml LBアンピシリン(100 g/ml)培地に植菌して12時間培養したものを、200mlLBアンピシリン(100 g/ml)培地に植菌して12時間培養したものを、200mlLBアンピシリン(100 g/ml)培地に1%植菌し、37℃で本培養を行った。植菌2.5〜3時間後(O.D.660=0.8〜1.0)に最終濃度が0.5mMになるようにIsopropyl- g/ml)培地に1%植菌し、37℃で本培養を行った。植菌2.5〜3時間後(O.D.660=0.8〜1.0)に最終濃度が0.5mMになるようにIsopropyl- -D-thiogalactopyranoside(IPTG)を添加し、12時間培養した後遠心分離して集菌した。超音波処理により菌体を破砕し遠心分離により可溶性画分を得た。この大腸菌粗抽出液を80℃で1時間加熱処理し大腸菌由来の蛋白質を変性させた後、遠心分離により不溶性画分を除き、その上清をブチルトヨパール、Mono Qのカラムクロマトグラフィーによって精製した。この酵素とT.litoralisから精製した標品を比較したところ、両者は同じ比活性を示し、SDS-PAGEにより等しい泳動距離を示した。このように本酵素を大腸菌で発現させることにより、本酵素の容易で効率的な精製が可能になった。 -D-thiogalactopyranoside(IPTG)を添加し、12時間培養した後遠心分離して集菌した。超音波処理により菌体を破砕し遠心分離により可溶性画分を得た。この大腸菌粗抽出液を80℃で1時間加熱処理し大腸菌由来の蛋白質を変性させた後、遠心分離により不溶性画分を除き、その上清をブチルトヨパール、Mono Qのカラムクロマトグラフィーによって精製した。この酵素とT.litoralisから精製した標品を比較したところ、両者は同じ比活性を示し、SDS-PAGEにより等しい泳動距離を示した。このように本酵素を大腸菌で発現させることにより、本酵素の容易で効率的な精製が可能になった。 第4章酵素反応生成物の特徴 馬鈴薯D酵素(Disproportionating enzyme)は、本酵素と同様の糖転移活性の他にアミロースの分子内転移反応を触媒し、重合度17から数百の環状 -1,4-グルカン(サイクロアミロース)を生成する活性のある4- -1,4-グルカン(サイクロアミロース)を生成する活性のある4- -グルカノトランスフェラーゼ(EC2.4.1.25)であることが知られている。本酵素について同様の検討を行ったところ、アミロースを基質とした時の酵素反応生成物は、グルコアミラーゼ(エキソアミラーゼ)に耐性であるが、 -グルカノトランスフェラーゼ(EC2.4.1.25)であることが知られている。本酵素について同様の検討を行ったところ、アミロースを基質とした時の酵素反応生成物は、グルコアミラーゼ(エキソアミラーゼ)に耐性であるが、 -アミラーゼにより加水分解されたことから、環状 -アミラーゼにより加水分解されたことから、環状 -1,4-グルカンであることが分かった。そして、環状生成物の重合度は16以上であった。これら生成物の性質から、本酵素は4- -1,4-グルカンであることが分かった。そして、環状生成物の重合度は16以上であった。これら生成物の性質から、本酵素は4- -グルカノトランスフェラーゼであることが分かった。 -グルカノトランスフェラーゼであることが分かった。 第5章4- -グルカノトランスフェラーゼのシステイン残基に関する蛋白質工学的研究 -グルカノトランスフェラーゼのシステイン残基に関する蛋白質工学的研究 本酵素遺伝子の塩基配列の解析結果から、本酵素には一個のシステイン残基Cys352が存在した。上で述べたように、本酵素はシステイン修飾試薬により強く阻害された。本酵素のCys352が活性に関与しているかどうかを検討するために、部位特異的変異によりシステイン残基を種々のアミノ酸残基に置換した変異型酵素を作成し、その酵素活性を調べた。その結果、変異型酵素の酵素活性は低下していたことから、Cys352が本酵素の活性部位を構成する残基の一つであることが明らかになった。 第6章4- -グルカノトランスフェラーゼ蛋白質の結晶化 -グルカノトランスフェラーゼ蛋白質の結晶化 4- -グルカノトランスフェラーゼ蛋白質の結晶化は、Crystal Screen Iを用いて4℃と25℃でSitting drop法で行った。その結果、4℃で0.02 M CaCl2・0.1 M Na acetate・30% 2-methyl-2,4-pentanediol(MPD)を沈殿剤溶液として用い、10mg/mlの蛋白質溶液1 -グルカノトランスフェラーゼ蛋白質の結晶化は、Crystal Screen Iを用いて4℃と25℃でSitting drop法で行った。その結果、4℃で0.02 M CaCl2・0.1 M Na acetate・30% 2-methyl-2,4-pentanediol(MPD)を沈殿剤溶液として用い、10mg/mlの蛋白質溶液1 lを使った時、10日後に結晶が認められた。 lを使った時、10日後に結晶が認められた。 |