真核細胞の細胞周期はDNA合成をするS期、細胞分裂をするM期、それぞれの準備期であるG1期、G2期に分けられる。特にG1期は細胞が増殖の方向に向かうのか或いは分化の方向に向かうのかを決定する重要な時期であり、この機構を解明することは細胞周期制御の解明に留まらず、個体発生に必須な細胞分化の制御や細胞癌化や老化の究明にも大いに貢献すると考えられる。真核細胞の中でも酵母は遺伝学的にも生化学的にも非常に優れた材料であり、特に分裂酵母は高等動物、特に動物細胞と極めて相同性の高い制御システムを持つことが知られている。こうした観点から私は、真核細胞のG1/S期の制御機構を明らかにするため、分裂酵母を材料に用いて研究を行ってきた。 分裂酵母には数々の細胞周期温度感受性変異株が存在する。私は細胞周期の新規開始制御因子を単離する目的で、pat1-114温度感受性株を高温で抑圧する遺伝子を分裂酵母のゲノムライブラリーからスクリーニングし、数種の新規遺伝子を得ることができた。そのうちの一つは興味深いことにpat1変異のみならず、G1/S進行に不可欠なcdc10変異も強く相補した。そこでこれをspt1+(suppressor of pat1 and cdc10<ten>)と名付け以降の解析を行うことにした。 まず、spt1+のcDNAをコロニーハイブリダイゼーションにより単離し、その塩基配列を決定したところ、カルボキシ末端にロイシンジッパーを1つ、アミノ末端にcAMP依存性キナーゼ(Aキナーゼ)によるリン酸化を受けうる部位を4つもつ、803アミノ酸からなるタンパクをコードする新規遺伝子であることが判明した。ホモロジー検索より、このタンパクは、出芽酵母のAlr1、Alr2(ともにアルミニウム耐性遺伝子と報告されている)、Ykg4(ゲノムプロジェクトにより報告されている)とC末で非常に高い相同性を持つことがわかった。しかし、当初得られたゲノムspt1+はcdc10変異に対して強い相補活性を持っていたが、完全長のcDNAとゲノムDNAは極めて低かった。そこで、アミノ末端の欠落が活性に影響を及ぼすものと考え、いろいろな長さのアミノ末端を欠落したspt1+遺伝子を作製しその活性を検討した。その結果、タンパクのアミノ末端1/3部分に活性を強く抑制する領域と残りのC末端側に活性に必須な領域があることがわかった(図1)。この欠落領域にはAキナーゼによるリン酸化を受けうる部位が4つ存在し、これを全て欠落したspt1+が最も高い相補活性をもつことから、このキナーゼによる制御を受けている可能性が考えられる。 次にspt1+遺伝子の機能を調べるためにspt1+遺伝子をura4+遺伝子で80%以上置き換えた遺伝子破壊株を作成した。四分子分析の結果spt1破壊株は生育可能ではあったが、36℃で弱い温度感受性を示し、30℃でも増殖速度が野生型株に比べ著しく遅れていた。また細胞も野生型株より伸長した形態をとり、いわゆるcdc表現型を示していた。spt1破壊株が細胞周期のどの時期で増殖遅延が起こっているのかを明らかにするため、培地から窒素源を枯渇させてG1停止させた後、窒素源を加えた培地に植菌し直して細胞周期を再開させた。フローサイトメトリーによる解析の結果、S期の開始と進行が大幅に遅延していることが判明した。しかしながら、S期の開始の遅れはこの解析結果だけではG0期から増殖周期に進入するのが遅いのかそれともS期の開始が遅れているのか知ることができない。そこで、細胞周期のG1後期で発現が開始し、DNA合成の開始制御に中心的な役割を果たしているcdc18+の発現を調べた。その結果、cdc18+の発現の開始はspt1破壊株と野生型株でほとんど差はなかった。しかしながら、野生型株では発現が細胞周期再開後3時間で最大になった後速やかに減少していくのに対し、spt1破壊株では発現が4時間で最大になりその後も発現は続き9時間後にやっと減少がみられた。このことから、spt1破壊株のS期開始の遅延は、cdc18+の発現開始点とDNA合成の開始点の間にあると結論づけられた。しかしながら、この結果からは破壊株の増殖遅延がG2/M期でも起こっているかどうかはわからない。そこで、今度は培地から硫黄源を枯渇させてG2停止させた後に、細胞周期を再開させる実験を行った。M期が進行したことは、核が二つになっている細胞の割合とseptation indexによって確認した。その結果、破壊株は野生型株とほとんど同時期に二核の細胞が増加するが、septumの形成が野生型株に比べ非常に遅く、また長い間分離しないことがわかった。分裂酵母ではseptumの形成はG1期に起こり、細胞の分離はS期の初期に起こる。したがって、この結果は破壊株はG2/M期の移行はほとんど遅れていないが、G1/S期の移行が遅れていることを示唆し、G1期停止から細胞周期を再開させたときの結果に一致している。 cdc18+のようにS期に必要な遺伝子はCdc10/Res転写複合体によって制御されていることが多い。そこでcdc25温度感受性変異株を用いて細胞周期を同調させspt1+の発現を調べた。結果はspt1+の発現は細胞周期を通じて一定であり、Cdc10/Res転写複合体の制御を受けないことが判明した。 出芽酵母では複製開始起点(ARS)の研究が進み、DNA複製の開始に関わる因子として、ORC(oigin recognition complex)、MCM(細胞周期一回につきDNA複製は一回しか起こらないことを決めていると考えられる)、Cdc6(DNA複製開始前複合体の形成に必要なキーファクターであり、且つMCMと同じような機能も有していると考えられる)が単離されている。分裂酵母や高等動物でもこれらのホモログが存在しDNA複製の開始が種を越えて保存されていることが示唆されている。spt1破壊株の解析よりSpt1がS期の開始と進行に必要であると考えられるが、これらの因子と共同で機能しているのかどうかを調べるために完全長及びアミノ末端を欠損させたspt1+遺伝子を様々なG1/S期の変異株に導入し、抑圧活性を調べた。その結果、アミノ末端を欠損したspt1+は温度感受性cdc18-K46,orp1(cdc30)-H5,cdc19-P1,cdc24-M38,cdc13-117株を抑圧することが判明した。cdc18+はCdc6のホモログを、orp1+はORC1ホモログを、cdc19+はMCM3を、cdc13+はBタイプサイクリンをコードしている遺伝子である。また、cdc24+はまだ同定中ではあるが、S期の進行に必要であり、DNAポリメラーゼ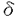 の機能に必要なPCNAやRFCと共同で機能していると考えられる。このことは活性化されたSpt1がCdc18やORC、MCMと複合体を形成して、DNA複製の開始や進行の制御に機能していることを示唆している。 の機能に必要なPCNAやRFCと共同で機能していると考えられる。このことは活性化されたSpt1がCdc18やORC、MCMと複合体を形成して、DNA複製の開始や進行の制御に機能していることを示唆している。 そこで実際にSpt1がCdc18やORCと結合するかどうか免疫沈降を行った。野生型株にFLAGタグをつけた完全長或いはN末を欠失させたSpt1と、HAタグをつけたCdc18或いはOrp1(ORC1)を発現させ、抗FLAG抗体で免疫沈降させた後抗HA抗体で免疫染色すると、完全長でもN末が欠失していてもSpt1はCdc18と複合体を形成する事がわかった。しかしながら、Orp1との結合は確認できなかった。 以上述べたごとく、私が単離した新規遺伝子spt1+は、複製開始に必要な因子Cdc18と複合体を形成して、DNA複製の開始と進行を制御していると考えられる(図2)。また、前述のように出芽酵母にはSpt1のホモログが3つ存在することより、分裂酵母にもspt1+と構造的にも機能的にも相同性を示す遺伝子の存在が予想され、現在我々の研究室で単離し解析を行っている。さらに、DNA複製開始に関わる因子は種を越えて保存されていることから、動物細胞にもspt1+遺伝子のホモログが存在すると考えられる。今後は分裂酵母でのDNA複製の開始を解明するとともに動物細胞でのspt1+遺伝子のホモログを単離し、動物細胞におけるDNA複製開始機構を究明していく計画である。 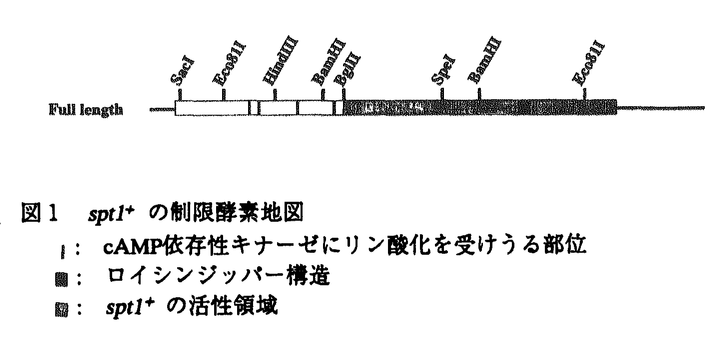 図1 spt1+の制限酵素地図l: cAMP依存性キナーゼにリン酸化を受けうる部位 ■: ロイシンジッパー構造 ■: spt1+の活性領域 図1 spt1+の制限酵素地図l: cAMP依存性キナーゼにリン酸化を受けうる部位 ■: ロイシンジッパー構造 ■: spt1+の活性領域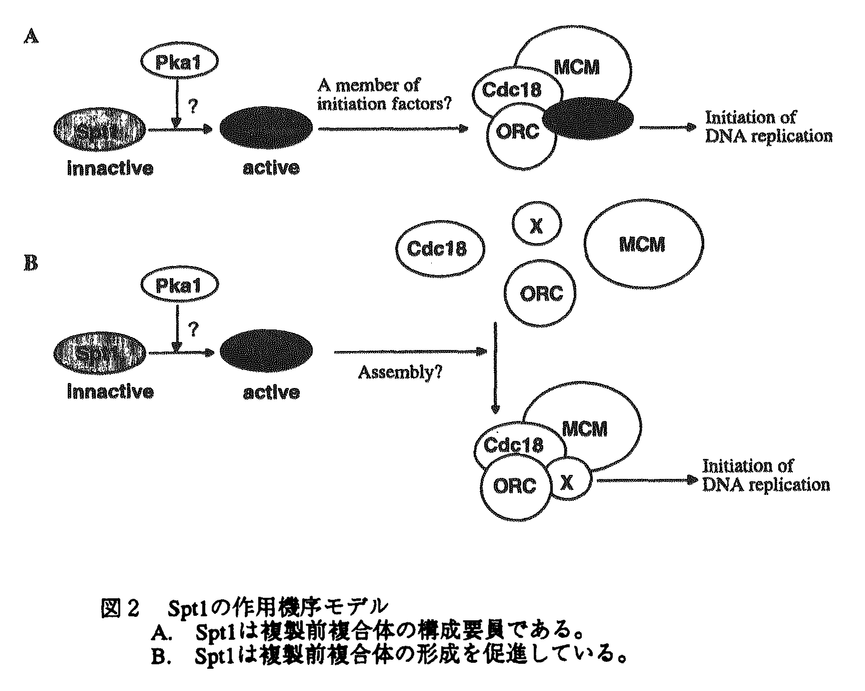 図2 Spt1の作用機序モデルA.Spt1は複製前複合体の構成要員である。 B.Spt1は複製前複合体の形成を促進している。 図2 Spt1の作用機序モデルA.Spt1は複製前複合体の構成要員である。 B.Spt1は複製前複合体の形成を促進している。 |