<背景> ホルモンや神経伝達物質などの様々な刺激によって細胞内にはイノシトール1,4,5三リン酸(IP3または(1,4,5)IP3)が産生される。IP3は細胞質を拡散し細胞内Ca2+プールである小胞体上のIP3受容体(IP3R)に結合して細胞質へのCa2+放出を引き起こす。細胞質内で上昇したCa2+イオンは細胞に様々な生理機能を引き起こすと考えられている。このようにIP3RはIP3という情報をCa2+という情報に変換する際、中心的な役割をになう分子である。
現在、哺乳動物には少なくとも3種類の異なった遺伝子によってコードされるIP3Rが存在することが明らかとなっている。小脳に豊富に存在するタイプ1IP3R(IP3R1)は2749アミノ酸(313kDa)からなる巨大蛋白質である。精製小脳IP3Rを用いた実験やIP3R1のcDNA発現実験から、IP3Rは四量体を形成しIP3依存性Ca2+チャネルとして機能することが示されている。IP3R1は構造的に3つの部分に分けられる。N末端側の細胞質に存在する大きな部分(全体の83%)、小胞体膜を6回貫通しCa2+チャネルとして機能すると考えられている部分(11%)とC末端側の細胞質に存在する部分(6%)である。
1分子のIP3Rには1分子のIP3が結合すること、その解離定数(Kd)は約100nMであることが精製小脳IP3Rを用いた実験から示されている。IP3結合部位を決定するために、欠失変異体を培養細胞で発現させる実験が行われた。この実験からIP3の結合はIP3R1のN末端650アミノ酸内で起こること、結合はIP3Rの四量体形成に依存しないことが示された。またこの領域内のかなり小さな欠失でもIP3結合活性が完全に消失することも示された。大腸菌内で発現させたグルタチオンS-トランスフェラーゼ融合IP3R蛋白を用いた実験から、IP3結合にはN末端576アミノ酸が十分であることが示されている。同時に、この領域からN末端またはC末端をさらに欠失させるとIP3結合活性が消失することも報告された。さらに、光親和性IP3アナログにより小脳IP3Rのアミノ酸471-501の領域が標識された。これらからIP3結合部位はIP3R1のN末端576アミノ酸内存在するいくつかのモチーフによって構成されることが想像された。
IP3の構造はイノシトール環の1,4,5位につくリン酸基によって特徴づけられる(図)。様々なイノシトールリン酸のアナログを用いたCa2+放出実験から、IP3Rは非常に厳密にリガンドの構造を認識することが示されている。リン酸基の数と位置がCa2+放出能に大きく影響することから、3つのリン酸基を認識する部位がIP3そのものの結合において重要な役割を担うことが示唆されている。これらの結果からIP3結合部位は塩基性アミノ酸からなるプラスに荷電したポケットで、静電気的な力を介してIP3のリン酸基と結合するというモデルが提唱された。
 図)イノシトール1,4,5三リン酸の構造<結果と考察>
図)イノシトール1,4,5三リン酸の構造<結果と考察> 大腸菌内で機能的なIP3結合領域を発現する系を確立した。大腸菌の培養温度を37℃にした場合、可溶性画分にはT734は検出されず発現蛋白はすべて不溶性の沈殿画分に回収された。しかし、IPTG添加後培養温度を28℃以下にした場合、可溶性画分にT734が検出された。可溶性画分のT734は高い[3H]IP3結合活性を示した。様々なイノシトールリン酸を用いた[3H]IP3結合の競合阻害実験から結合特異性を検討した。結合特異性は(1,4,5)IP3>(2,4,5)IP3>(1,3,4,5)IP4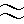 (4,5)IP2の順であった。スキャッチャード解析からT734の(1,4,5)IP3に対する解離定数(Kd)50nMを得た。これらの結果は小脳IP3Rが示す結合特異性とKdにほぼ等しいことから、大腸菌で発現させたT734は小脳IP3Rのリガンド結合部位と同じ構造をとると考えられた。
(4,5)IP2の順であった。スキャッチャード解析からT734の(1,4,5)IP3に対する解離定数(Kd)50nMを得た。これらの結果は小脳IP3Rが示す結合特異性とKdにほぼ等しいことから、大腸菌で発現させたT734は小脳IP3Rのリガンド結合部位と同じ構造をとると考えられた。
この系を用いて、変異体蛋白のIP3結合活性を解析することによりIP3結合に関与する部位の同定を試みた。
はじめにIP3結合領域の境界を明確にすることを目的に、T734のコンストラクトを基に2つの内部欠失変異体と15個のN末端欠失変異体を作製した。アミノ酸579-649を欠く変異体はIP3結合活性を示したのに対し、568-649を欠く変異体のIP3結合活性は消失した。この結果から、IP3結合領域のC端側の境界はアミノ酸568から578の間にあると考えられた。これはNewtonら(1994)が報告したN末端576アミノ酸がIP3結合活性をもつという結果に一致する。T734からN末端31アミノ酸を削るとIP3結合活性は消失した。N末端215アミノ酸まで欠失を徐々に大きくさせてもIP3結合活性は検出されなかった。ところがN末端220アミノ酸を欠いた変異体は再びIP3結合活性を示した。この結合活性の回復はN末端223と225アミノ酸を欠いた変異体でも観察された。N末端の228アミノ酸以上を欠いた変異体では再びIP3結合活性が消失した。これらの結果から、IP3結合領域のN端側の境界はアミノ酸226から228の間にあると考えられた。
欠失変異体の実験からアミノ酸226-578の領域がIP3結合に必要な最小領域であることが分かった。そこでこの領域が特異的IP3結合に十分な領域であるかどうかを検討することを目的に、アミノ酸224-579の356アミノ酸を発現させた。この356アミノ酸からなる発現蛋白は高いIP3結合活性(Kd=2.3nM)とT734と同じ結合特異性を示したことから、この領域がIP3結合に十分であることが分かった。この領域がIP3結合コアを形成することが示唆された。
いかなるアミノ酸がIP3結合に関与するかを明らかにするために、Argとリジン(Lys)に対して部位特異的変異を導入した。標的としたArgとLysは、以下に記す3つの基準に従って選んだ。アミノ酸226-578に存在し、(i)これまでクローニングされたすべてのIP3Rで保存されているもの(26ヵ所)、(ii)完全に保存されていないが保存性が高いもの(7ヵ所)。(iii)アミノ酸1-225または579-650に存在し、なおかつコンピュータで予測されるサーフェースプロバビリティが高い領域にあるもの(8ヵ所)。以上、41ヵ所の塩基性アミノ酸を単独かまたは2つ以上をまとめて、中性アミノ酸であるグルタミン(Gln)に置換した。
部位特異的変異体はIP3結合活性を基に4つのグループに分類できた。(i)IP3結合活性が完全に消失した変異体、(ii)部分的に結合活性が消失した変異体、(iii)結合活性が上昇した変異体、(iv)結合活性が変化しなかった変異体である。1アミノ酸置換によりIP3結合活性が減少した10ヵ所のアミノ酸(Arg-241,Lys-249,Arg-265,Arg-269,Arg-504,Arg-506,Lys-508,Arg-511,Arg-568,Lys-569は)はすべてアミノ酸226-578の領域に位置していた。またこれらのアミノ酸はすべてのIP3Rで保存されていたことから、機能の重要性が示唆された。これらのうち、Arg-265、Lys-508、Arg-511は1アミノ酸置換によりIP3結合活性が完全に消失したことから、IP3結合に必須なアミノ酸であると考えられた。
Arg-568をGlnに置換した変異体は部分的にIP3結合活性を欠くが、この変異体のイノシトールリン酸に対する結合特異性((1,4,5)IP3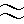 (2,4,5)IP3>(4,5)IP2>(1,3,4,5)IP4)は変異をもたない野生体の結合特異性と異なっていた。Arg-568はリガンド結合の特異性に関与するかもしれない。
(2,4,5)IP3>(4,5)IP2>(1,3,4,5)IP4)は変異をもたない野生体の結合特異性と異なっていた。Arg-568はリガンド結合の特異性に関与するかもしれない。
IP3Rが3次構造をとったとき、アミノ酸226-578に分散して存在する10ヵ所の塩基性アミノ酸が互いに近接しプラスに荷電したポケットを形成しIP3のリン酸基との結合に関与することが示唆された。