本研究は、Ca2+をセカンドメッセンジャーとする細胞内情報伝達機構において重要な役割を演じていると考えられる、イノシトール三リン酸(IP3)受容体(IP3R)の、異なる遺伝子にコードされた2つのタイプ -タイプ1(IP3R1)およびタイプ3(IP3R3)-の機能的な性質の相違を明らかにするために、バキュロウイルス蛋白発現系によるそれぞれのIP3RのcDNAからの発現と、それらの生化学的な解析を試みたものであり、以下の結果を得ている。 1.ヒトIP3R1およびIP3R3cDNAを用いて組み換えバキュロウイルスを作製し、これらを感染させることにより、ヨトウガ由来の株化細胞であるSf9にIP3R cDNAを導入し、その膜画分について解析した(それぞれ、IP3R1/Sf9およびIP3R3/Sf9)。これらの膜画分について、タイプ特異的モノクローナル抗体を用いたwestern blottingにより目的の遺伝子産物の発現が確認され、IP3R binding asseyにより高くかつ特異的なIP3R結合活性が確認された。他の系では困難であった、大きな(約260kd)膜タンパクであるIP3Rの機能的な大量発現に成功した。これによってIP3Rのタイプ間の機能的な性質の相違を直接に比較することが可能になった。 2.両タイプのIP3RのIP3結合特性にCa2+がおよぼす影響を調べたところ、IP3R1とIP3R3に対するIP3結合特性はCa2+によって相異なる調節をうけていることが明らかになった。IP3R1のIP3結合は[Ca2+]依存的に減少した。EC50は100nMであり、生理的細胞内[Ca2+]全域に相当する10-9〜10-5MにおいてIP3結合の変化がみられた(slope factor-0.75)。一方、IP3R3のIP3結合は[Ca2+]依存的に増加した。比較的高い[Ca2+]において急峻なIP3結合の変化がみられた(EC50=872nM,10-7〜10-5M,slope factor2.7)。IP3結合の変化は、いずれのタイプも、可逆的であった。Scatchard analysesの結果、IP3R1は[Ca2+]=3nMのときKd=78.5nM,[Ca2+]=1.4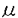 MのときKd=312nMであり、IP3R3は[Ca2+]=3nMのときKd=116nM,[Ca2+]=1.4 MのときKd=312nMであり、IP3R3は[Ca2+]=3nMのときKd=116nM,[Ca2+]=1.4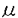 MのときKd=59.6nMであった。Bmaxは、いずれのタイプも、[Ca2+]によってほとんど変化しなかった。これらの結果により、(i)IP3R1,IP3R3ともに少なくとも2つのリガンド親和性状態をもち、(ii)Ca2+がこれらの状態間の遷移を調節しており、(iii)IP3R1とIP3R3とではCa2+による遷移に調節の方向が逆であることが明らかになった。 MのときKd=59.6nMであった。Bmaxは、いずれのタイプも、[Ca2+]によってほとんど変化しなかった。これらの結果により、(i)IP3R1,IP3R3ともに少なくとも2つのリガンド親和性状態をもち、(ii)Ca2+がこれらの状態間の遷移を調節しており、(iii)IP3R1とIP3R3とではCa2+による遷移に調節の方向が逆であることが明らかになった。 以上、本論文は、同一の株化細胞を用いてcDNAから発現したIP3R1およびIP3R3の解析により、各タイプのIP3RはCa2+によってまったく異なる調節をうけていることを明らかにした。本研究は、組織や細胞によって大きく異なる多様な細胞内のカルシウム動態の機構と性質の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |