| 1緒言 アルツハイマー病(アルツハイマー型老年痴呆)は、初老期および老年期に発症し、徐々に進行する原因不明の痴呆を呈する疾患である。その病理学的特徴は、おもにアミロイド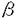 蛋白の沈着凝集により形成される老人斑の出現、神経原線維変化、神経細胞死による脳の萎縮があげられる。またアルツハイマー病の多くは、孤発性のものであるが、なかに稀ではあるが、家族性アルツハイマー病と呼ばれ、常染色体優性遺伝性を示すものもある。家族性アルツハイマー病の原因遺伝子は連鎖解析等により現在までに21番染色体上のAPP、14番染色体上のpresenilin1、1番染色体上のpresenilin2が同定されてきており、また19番染色体上のapolipoprotein Eが危険因子であることも報告されている。しかし、孤発性アルツハイマー病の遺伝子のレベルでの原因は全く不明であり、その発症メカニズムは未知である。孤発性アルツハイマー病を正常からの遺伝子発現等のゆらぎと考えると、正常コントロール脳と孤発性アルツハイマー病脳とで発現の異なる遺伝子を検索することが、発症メカニズムの解明に重要だと考えられる。そこでまず既に同定された家族性アルツハイマー病の原因遺伝子の発現量、発現場所に変化がないかを調べることを試みる。既にAPPに関しては発現に変化はないという報告があり、一方apolipoprotein Eに関しては孤発性でも対立遺伝子 蛋白の沈着凝集により形成される老人斑の出現、神経原線維変化、神経細胞死による脳の萎縮があげられる。またアルツハイマー病の多くは、孤発性のものであるが、なかに稀ではあるが、家族性アルツハイマー病と呼ばれ、常染色体優性遺伝性を示すものもある。家族性アルツハイマー病の原因遺伝子は連鎖解析等により現在までに21番染色体上のAPP、14番染色体上のpresenilin1、1番染色体上のpresenilin2が同定されてきており、また19番染色体上のapolipoprotein Eが危険因子であることも報告されている。しかし、孤発性アルツハイマー病の遺伝子のレベルでの原因は全く不明であり、その発症メカニズムは未知である。孤発性アルツハイマー病を正常からの遺伝子発現等のゆらぎと考えると、正常コントロール脳と孤発性アルツハイマー病脳とで発現の異なる遺伝子を検索することが、発症メカニズムの解明に重要だと考えられる。そこでまず既に同定された家族性アルツハイマー病の原因遺伝子の発現量、発現場所に変化がないかを調べることを試みる。既にAPPに関しては発現に変化はないという報告があり、一方apolipoprotein Eに関しては孤発性でも対立遺伝子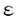 4の頻度が、対照に比べて有意に高いが、発症に十分ではなく、やはり危険因子であると報告されている。そこで1995年に新たに同定された14番染色体上の原因遺伝子presenilin1について、孤発性アルツハイマー病患者脳とコントロール脳とで転写レベルでの発現を比較した。次に孤発性アルツハイマー病で転写レベルでの発現が変化している新たな遺伝子を検索することにした。 4の頻度が、対照に比べて有意に高いが、発症に十分ではなく、やはり危険因子であると報告されている。そこで1995年に新たに同定された14番染色体上の原因遺伝子presenilin1について、孤発性アルツハイマー病患者脳とコントロール脳とで転写レベルでの発現を比較した。次に孤発性アルツハイマー病で転写レベルでの発現が変化している新たな遺伝子を検索することにした。 2用いた方法と実験のアウトライン (1)ヒト正常コントロール脳とラット脳におけるpresenilin 1の発現場所をin situ hybridizationにより確認した。 (2)神経系株細胞とグリア系株細胞、ヒトの各組織におけるpresenilin 1の発現をRT-PCR、ノザンブロットの手法を用いてみてみた。 (3)正常コントロール脳と孤発性アルツハイマー病脳でpresenilin 1の発現場所に変化があるかをin situ hybridizationの手法を用いてみてみた。 (4)Differential Hybridizationを改良したHigh Density cDNA Filters Analysis(HDCFA)により、孤発性アルツハイマー病患者脳とコントロール脳の大脳皮質前頭葉で発現に変化のある遺伝子を検索した。 (5)Differential Displayを用いて孤発性アルツハイマー病患者脳とコントロール脳の大脳皮質前頭葉で発現に変化のある遺伝子を検索した。 (6)顕著に発現に変化のあった一つのcDNAの全長をdideoxy法により決定した。 (7)同cDNA(gene)に関してノザンブロット、RT-PCRにより、ヒトの各組織、細胞での発現をみた。 (8)同cDNA(gene)に関してヒトとラットの脳での発現場所をin situ hybridizationの手法を用いて検索した。 (9)同cDNA(gene)のsenseとantisenseの20-merのホスホロチオエート型オリゴDNAを神経系株細胞に導入した後、細胞からDNAを抽出し断片化をみた。 3結果 ヒト正常コントロール脳とラット脳でpresenilin1mRNAの発現場所を、in situ hybridization法を用いて検索した結果、脳だけではなく、heart、liver、spleenなどの非神経系組織でも発現が見られた。ヒトとラットの脳内でも広い範囲にわたり発現が見られたが、両方の種で発現パターンは類似しており、いずれも海馬や小脳の細胞層で高い発現が見られ、低いレベルのシグナルが白質でみられた。さらに細胞レベルのミクロ写真では、銀粒子が脳内の神経細胞に優勢に存在し、少量の銀粒子がグリア部分にみられた。また、RT-PCRにより、神経系株細胞LA-N-5とグリア系株細胞U251とで発現を比較したところ、前者でより強い発現をしていることがわかった。以上からpresenilin1mRNAは脳内では神経細胞で強い発現をしているが、グリア細胞でも弱く発現をしていることが強く示唆された。また、ノザンブロットの結果はヒトの組織広範にわたってpresenilin1mRNAが発現しており、調べた組織の中ではtestisで最も強い発現が見られた。 さらに孤発性アルツハイマー病患者脳の、神経原線維変化(NFT)のある海馬台の神経細胞、NFTのない海馬CA3領域の神経細胞と小脳プルキンエ細胞でのpresenilin1mRNAの発現をin situ hybridizationの手法を用いてみてみた。同様に正常コントロール脳でも発現をみた。すると、小脳プルキンエ細胞での発現は孤発例と正常例で差がなく、またpresenilin1mRNAの発現はNFTのあるなしによる差はみられなかった。 次に孤発性アルツハイマー病患者脳3例とコントロール脳4例の大脳皮質前頭葉からmRNAを抽出した。次に大脳皮質cDNAライブラリーをin vivo excisionによりプラスミド化し、高頻度出現クローンを除き重複を少なくしたプラスミド、約8300を高密度にメンブレン上にドットしたフィルターを作製した。先に抽出したmRNAを逆転写することにより放射活性をもったcDNAプローブを作製し、このフィルターに対してDifferential hybridizationを行った。また同時に孤発性アルツハイマー病患者脳10例とコントロール脳3例の大脳皮質前頭葉mRNAのDifferential Displayを行い、約2000のcDNAバンドを比較した。このようにして両法あわせて約10000種のcDNAを検索した。 その結果、コントロール脳に対して、孤発性アルツハイマー病患者脳で発現の上昇のみられたもの19、発現の減少のみられたもの12を単離した。これらの部分塩基配列を決定し、ホモロジー検索を行ったところ、孤発性アルツハイマー病患者脳で発現の上昇しているものにFas、また発現の減少しているものにDAP-1などがみつかったが、多くは新規な遺伝子であった。 これらの新規cDNAの解析に際し、孤発性アルツハイマー病患者脳で発現が顕著に減少している9-1cDNAから解析を進めていくことにした。まずノザンブロット解析を行ったところ、遺伝子産物の大きさは約4.2kbであり、各組織で比較的ユビキタスに発現しているが脳内では海馬、扁桃核など神経細胞の密度の高いところで強い発現がみられた。また神経系株細胞のLA-N-5、SH-SY5Yで発現がみられるが、グリア系株細胞のU-251では発現が検出されなかった。またヒト胎児脳とヒト成人脳とを比較すると後者で発現が多かった。さらにin situ hybridizationによりラットとヒトの脳での発現を見たところ両者ともノザンの結果同様に海馬、扁桃核など神経細胞の密度の高いところで強い発現がみられた。これらにより9-1cDNAは神経細胞で強く発現していることがわかった。 9-1cDNAの全長塩基配列を決定した結果、予想されるオープンリーディングフレームは1128アミノ酸であり、ホモロジー検索の結果、ラットNap1のヒトホモログと考えられた(hNap1と命名)。アミノ酸配列上特にモチーフ等はみつからなかったが、蛋白質構造予測プログラム、PSORTを用いたところ、hNap1の産物は一回膜貫通型蛋白と予測された。またhNap1がどの染色体上にあるかを決定するために、Hybrid cell panelを用いてマッピングを行ったところ、ヒト2番染色体上にのっている遺伝子の転写産物であることがわかった。さらにFluorescence in situ hybridization(FISH)を行い2番染色体上の2q32.1-q32.2にあることを確認した。 次にhNap1の機能を探るために、20-merのセンスとアンチセンスのホスホロチオエート型オリゴDNA(S-oligo)を合成し神経系株細胞SH-SY5Y培養培地中に、LipofectAMINEとともに4.5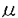 Mの濃度で12時間添加し、添加後12時間ごとに経時的にDNAを細胞から抽出しアガロースゲルで電気泳動を行った。するとアンチセンスS-oligoの添加から48時間を経たもの以降から抽出したDNAで顕著に断片化が検出された。これはアンチセンスS-oligo添加時に特異的で、センスS-oligo、またLipofectAMINEのみを加えたときには検出されなかった。またアンチセンスS-oligo添加後にのみ培養細胞が死んで浮遊してくるものが多数観察され、さらにin situ end labeling法を行ったところ、クロマチンの凝縮がみられた。以上によりアンチセンスS-oligo添加によりSH-SY5Y細胞にアポトシスが誘導されたと考えられる。次にこのときhNap1の発現がmRNAレベルで抑えられているかを調べるために、アンチセンスS-oligo添加後、経時的にRNAを抽出しRT-PCRを行った。その結果hNap1の発現は添加前には検出されたが、12時間の添加の後すぐに検出されなくなった。従って誘導されたアポトシスはhNap1の発現の減少によるものと考えられる。またSH-SY5Y細胞にレチノイン酸で分化誘導をかけた後に、hNap1のアンチセンスS-oligoを培地中に添加した際にも同様にアポトシスが誘導された。さらに別の神経系株細胞のLA-N-5でも同様にアポトシスが誘導された。 Mの濃度で12時間添加し、添加後12時間ごとに経時的にDNAを細胞から抽出しアガロースゲルで電気泳動を行った。するとアンチセンスS-oligoの添加から48時間を経たもの以降から抽出したDNAで顕著に断片化が検出された。これはアンチセンスS-oligo添加時に特異的で、センスS-oligo、またLipofectAMINEのみを加えたときには検出されなかった。またアンチセンスS-oligo添加後にのみ培養細胞が死んで浮遊してくるものが多数観察され、さらにin situ end labeling法を行ったところ、クロマチンの凝縮がみられた。以上によりアンチセンスS-oligo添加によりSH-SY5Y細胞にアポトシスが誘導されたと考えられる。次にこのときhNap1の発現がmRNAレベルで抑えられているかを調べるために、アンチセンスS-oligo添加後、経時的にRNAを抽出しRT-PCRを行った。その結果hNap1の発現は添加前には検出されたが、12時間の添加の後すぐに検出されなくなった。従って誘導されたアポトシスはhNap1の発現の減少によるものと考えられる。またSH-SY5Y細胞にレチノイン酸で分化誘導をかけた後に、hNap1のアンチセンスS-oligoを培地中に添加した際にも同様にアポトシスが誘導された。さらに別の神経系株細胞のLA-N-5でも同様にアポトシスが誘導された。 4考察 In situ hybridizationの手法によりpresenilin1mRNAの発現はヒトの脳で神経細胞で強く、グリア細胞では弱い発現があることを確認した。また孤発性アルツハイマー病患者脳とコントロール脳とでpresenilin1mRNAの発現は基本的に差が無く、またNFTの存在する領域の神経細胞と存在しない領域の神経細胞とでも変化がないため、NFTのおこりやすさ、即ち孤発性アルツハイマー病での侵されやすさとpresenilin1mRNAの発現は関連がないと考えられる。従って、presenilin1の変異は家族性アルツハイマー病で疾患を引き起こすが、孤発性アルツハイマー病ではそのmRNA量が直接的に疾患を引き起こすのではないと考えられる。 hNap1の発現の減少が、少なくとも神経系株細胞においては一般的にアポトシスを誘導する可能性が示唆された。発現が抑制されることにより、アポトシスが誘導されるものとしては、細胞周期関係のものとしてc-myc、免疫関連のものではbcl2などが知られているが、それらと相同性を示さない新規なものとしてhNap1が加わった。今後hNap1がアポトシスの経路のどこではたらいているか調べることは、その機能を探るために重要と考えられる。hNap1が孤発性アルツハイマー病で発現が減少していることが、神経細胞の脱落による結果である可能性は否定できないが、hNap1の発現の減少自体がアポトシスを引き起こすことから、この遺伝子が孤発性アルツハイマー病に関与している可能性が示唆される。また、hNap1はヒト2番染色体上の遺伝子であるが、2番染色体は後期発症型家族性アルツハイマー病遺伝子との連鎖が報告されている染色体であるので後期発症型家族性アルツハイマー病との関連が興味深い。これらの培養細胞で明らかになってきたhNap1とアポトシスとの関係が果たして実際に、孤発性アルツハイマー病脳での顕著な神経細胞死と関連があるかは不明だが、それを明らかにするためにはhNap1自身に果たしてアポトシス抑制機能があるかの解析に加え、hNap1産物と相互作用する産物の同定、遺伝子破壊マウスの作製が大きなヒントを与えてくれるものと思われる。 |