インターロイキン7(IL-7)はpre B細胞の増殖を支持する増殖因子として同定された糖タンパクである。その後、IL-7はpre B細胞のみならず未熟胸腺細胞に作用して増殖させることが判明した。さらにin vivoでのIL-7の機能を調べるために、抗IL-7ならびに抗IL-7レセプター(IL-7R)抗体をマウスに投与する実験が行われ、IL-7/IL-7Rシグナル伝達システムがB細胞ならびにT細胞の生成に重要であることが明らかになった。 そこで私は生体内におけるIL-7Rの機能を詳細に解明する目的で、IL-7R欠損マウスを作製しその解析を行った。その結果、IL-7RからのシグナルがT細胞およびB細胞の初期分化に重要であり、特に 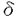 T細胞の分化もしくは維持に必須であることが明らかになった。IL-7が T細胞の分化もしくは維持に必須であることが明らかになった。IL-7が 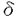 T細胞におよぼす作用として、(1)T細胞レセプター(TCR) T細胞におよぼす作用として、(1)T細胞レセプター(TCR) 鎖遺伝子のV-J組み換えを誘導すること、(2) 鎖遺伝子のV-J組み換えを誘導すること、(2) 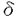 T細胞に維持・増殖因子として働くことの2つが示唆されているが、IL-7R欠損マウスのT細胞におけるV-(D)-J組み換えについて解析したところIL-7RマウスではTCR T細胞に維持・増殖因子として働くことの2つが示唆されているが、IL-7R欠損マウスのT細胞におけるV-(D)-J組み換えについて解析したところIL-7RマウスではTCR 鎖遺伝子のV-J組み換えが欠失していることが明らかになった。従って本研究により、IL-7RからのシグナルがTCR 鎖遺伝子のV-J組み換えが欠失していることが明らかになった。従って本研究により、IL-7RからのシグナルがTCR 鎖遺伝子特異的なV-J組み換え誘導に必須であることが明らかになった。 鎖遺伝子特異的なV-J組み換え誘導に必須であることが明らかになった。 まず、ジーンターゲティング法によりIL-7R欠損マウスを作製した。129系マウス染色体ライブラリーより4IIL-7R染色体遺伝子を単離し、IL-7R第2エクソンをネオマイシン耐性遺伝子に置換するターゲティングベクターを構築した。このDNAをES細胞にエレクトロポレーション法によって導入し、145個の薬剤耐性クローンから2個の相同組み換え体をサザン法で同定した。これら2クローンのうち1クローンから作製したキメラマウスはES細胞の性質を子孫に伝達し、これらヘテロ接合体間の交配によりIL-7R欠損マウスを得た。IL-7R欠損マウスはメンデル比に従って得られ、同腹の野生型マウスとの間に外見上の差は認められなかった。IL-7Rの発現を調べたところ、IL-7R欠損マウスではエクソン2を欠損するmRNAを発現していたが、抗IL-7R単クローン抗体を用いてFACS解析したところ細胞表面へのIL-7Rの発現は認められなかった。 つぎに、IL-7R欠損マウスおけるリンパ球の分化をFACSを用いて解析した。IL-7R欠損マウスのリンパ球は正常マウスに比べ、骨髄では1/2に、胸腺では1/100に、脾臓では1/10程度に減少していた。B細胞ならびにT細胞の分化段階をFACSで解析したところ、骨髄のB細胞はHardyらの分類によるfraction AからBで、胸腺のT細胞はCD4-CD8-分画中のCD44+CD25-からCD44+CD25+の段階で分化が障害されていた。しかしながら、末梢にはB細胞ならびにT細胞が正常マウスの1/10程度ながらも存在しており、これらをLPSならびにCon Aで刺激したところ3H-チミジンの取り込みは正常であった。このことは、IL-7R欠損によってリンパ球の分化・増殖が重度に障害されるものの、末梢における増殖反応は阻害されないことを示唆する。さらに 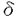 T細胞をFACSで解析したところ、胸腺、脾臓、腸管上皮、肝臓において T細胞をFACSで解析したところ、胸腺、脾臓、腸管上皮、肝臓において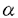 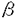 T細胞は存在するものの、 T細胞は存在するものの、 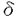 T細胞は完全に欠失することが明らかになった。また皮膚上皮に分布する T細胞は完全に欠失することが明らかになった。また皮膚上皮に分布する 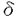 T細胞の一種であるDendritic Epidermal T Cells(DETC)も完全に欠失していた。一方、IL-7R欠損マウスではNK細胞は正常に存在し、NK活性についても野生型マウスとIL-7R欠損マウスとの間に著明な差は認められなかった。 T細胞の一種であるDendritic Epidermal T Cells(DETC)も完全に欠失していた。一方、IL-7R欠損マウスではNK細胞は正常に存在し、NK活性についても野生型マウスとIL-7R欠損マウスとの間に著明な差は認められなかった。 以上の結果から、IL-7Rからのシグナルはリンパ球の初期分化に重要であり特に 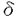 T細胞の分化もしくは維持に必須であること、ならびにNK細胞の分化・増殖にはIL-7Rからのシグナルは必須でないことが明らかになった。 T細胞の分化もしくは維持に必須であること、ならびにNK細胞の分化・増殖にはIL-7Rからのシグナルは必須でないことが明らかになった。 IL-7が 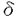 T細胞に及ぼす作用として、TCR T細胞に及ぼす作用として、TCR 鎖遺伝子のV-J組み換えを誘導すること、ならびに 鎖遺伝子のV-J組み換えを誘導すること、ならびに 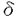 T細胞の維持・増殖因子として働くことが2つ示唆されている。そこでこの問題を明らかにするために私はIL-7R欠損マウスのTCR遺伝子のV-(D)-J組み換えについて解析した。 T細胞の維持・増殖因子として働くことが2つ示唆されている。そこでこの問題を明らかにするために私はIL-7R欠損マウスのTCR遺伝子のV-(D)-J組み換えについて解析した。 まずIL-7Rヘテロ接合体ならびにIL-7R欠損マウスの胸腺細胞からDNAを抽出し、これらマウスの胸腺細胞DNAにおけるV-(D)-J組み換えをJ 1,J 1,J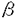 2,J 2,J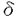 1,J 1,J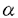 1プローブを用いてサザン解析した。その結果、IL-7Rヘテロ接合体マウスの胸腺細胞DNAではJ 1プローブを用いてサザン解析した。その結果、IL-7Rヘテロ接合体マウスの胸腺細胞DNAではJ 1とJ 1とJ 2locusの70%以上のalleleで組み換えが認められ、V 2locusの70%以上のalleleで組み換えが認められ、V 1.2-J 1.2-J 2ならびにV 2ならびにV 2-J 2-J 1組み換え体が検出された。しかしながら、IL-7R欠損マウスではTCR 1組み換え体が検出された。しかしながら、IL-7R欠損マウスではTCR 鎖遺伝子のV 鎖遺伝子のV 1.2-J 1.2-J 2とV 2とV 2-J 2-J 1組み換え、ならびにそれに伴うgermline fragmentの減少は検出できなかった。一方、J 1組み換え、ならびにそれに伴うgermline fragmentの減少は検出できなかった。一方、J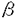 2,J 2,J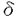 1,J 1,J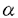 1プローブを用いたサザン解析では、TCR 1プローブを用いたサザン解析では、TCR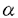 , ,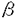 , ,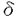 鎖遺伝子のV-(D)-J組み換えについて両者の間に著明な差は認められなかった。 鎖遺伝子のV-(D)-J組み換えについて両者の間に著明な差は認められなかった。 さらに詳細に調べるために、IL-7R欠損マウスの胸腺細胞DNAにおけるV-(D)-J組み換えをTCR 鎖、 鎖、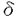 鎖、 鎖、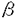 鎖遺伝子のプライマーを用いてPCR法により解析した。その結果、IL-7R欠損マウスではすべてのTCR 鎖遺伝子のプライマーを用いてPCR法により解析した。その結果、IL-7R欠損マウスではすべてのTCR 鎖遺伝子のV-J組み換えが著明に減少していた。しかしながら、TCR 鎖遺伝子のV-J組み換えが著明に減少していた。しかしながら、TCR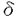 鎖遺伝子のV-D-J組み換えについてはIL-7Rヘテロ接合体マウスとIL-7R欠損マウスとの間に著明な差は認められなかった。最近、fetal thymic organ cultureにおいてIL-7がTCR 鎖遺伝子のV-D-J組み換えについてはIL-7Rヘテロ接合体マウスとIL-7R欠損マウスとの間に著明な差は認められなかった。最近、fetal thymic organ cultureにおいてIL-7がTCR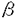 鎖遺伝子のD-J組み換えを誘導することが報告されていたが、本実験ではTCR 鎖遺伝子のD-J組み換えを誘導することが報告されていたが、本実験ではTCR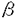 鎖遺伝子のD-J組み換えならびにV-DJ組み換えについてIL-7Rヘテロ接合体マウスとIL-7R欠損マウスとの間に著明な差は認められなかった。 鎖遺伝子のD-J組み換えならびにV-DJ組み換えについてIL-7Rヘテロ接合体マウスとIL-7R欠損マウスとの間に著明な差は認められなかった。 またV-D-J組み換えに関与するRag-1,Rag-2,Ku-80,TdT遺伝子の発現についてRT-PCR法により解析したところ、IL-7Rヘテロ接合体マウスとIL-7R欠損マウスとの間に著明な差は認められなかった。 以上の結果、IL-7RからのシグナルがTCR 鎖遺伝子特異的なV-J組み換えを誘導すること、ならびにすべてのTCR 鎖遺伝子特異的なV-J組み換えを誘導すること、ならびにすべてのTCR 鎖遺伝子のV-J組み換えに必須であることが明らかになった。従ってIL-7R欠損マウスが 鎖遺伝子のV-J組み換えに必須であることが明らかになった。従ってIL-7R欠損マウスが 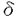 T細胞が欠失する原因の少なくとも1つは、TCR T細胞が欠失する原因の少なくとも1つは、TCR 鎖遺伝子のV-J組み換えが誘導されないことであることが示唆された。 鎖遺伝子のV-J組み換えが誘導されないことであることが示唆された。 IL-7Rはcommon 鎖とヘテロダイマーを構成する。また、このcommon 鎖とヘテロダイマーを構成する。また、このcommon 鎖はIL-7Rのみならず、他のサイトカインレセプター(IL-2R、IL-4R、IL-9R、IL-15R)に共有される。IL-2、IL-4ならびに両者を欠損するマウスではリンパ球の初期分化に異常は認められないものの、common 鎖はIL-7Rのみならず、他のサイトカインレセプター(IL-2R、IL-4R、IL-9R、IL-15R)に共有される。IL-2、IL-4ならびに両者を欠損するマウスではリンパ球の初期分化に異常は認められないものの、common 鎖を欠損するマウスではリンパ球の初期分化と末梢での増殖が障害され特に 鎖を欠損するマウスではリンパ球の初期分化と末梢での増殖が障害され特に 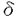 T細胞とNK細胞が欠失する。本研究で得られた結果から、リンパ球の初期分化と T細胞とNK細胞が欠失する。本研究で得られた結果から、リンパ球の初期分化と 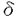 T細胞の分化もしくは維持にはIL-7R/common T細胞の分化もしくは維持にはIL-7R/common 鎖からのシグナルが必須であり、末梢でのリンパ球の増殖反応とNK細胞の分化・維持にはIL-15R等のcommon 鎖からのシグナルが必須であり、末梢でのリンパ球の増殖反応とNK細胞の分化・維持にはIL-15R等のcommon 鎖を共有する他のサイトカインレセプターからのシグナルが重要であることが示唆される。 鎖を共有する他のサイトカインレセプターからのシグナルが重要であることが示唆される。 また本研究によりIL-7RからのシグナルがTCR 鎖遺伝子に特異的なV-J組み換えの誘導に必須であることが明らかになった。最近、免疫グロブリンやTCR遺伝子のlineageならびにstage特異的なV-(D)-J組み換えを調節する機構としてエンハンサーによる制御が示唆されている。従って、IL-7RからのシグナルがTCR 鎖遺伝子に特異的なV-J組み換えの誘導に必須であることが明らかになった。最近、免疫グロブリンやTCR遺伝子のlineageならびにstage特異的なV-(D)-J組み換えを調節する機構としてエンハンサーによる制御が示唆されている。従って、IL-7RからのシグナルがTCR 鎖遺伝子のエンハンサーに作用してTCR 鎖遺伝子のエンハンサーに作用してTCR 鎖遺伝子に特異的なV-J組み換えを制御していることが考えられる。IL-7はT細胞においてSTAT5を活性化する。さらにTCR 鎖遺伝子に特異的なV-J組み換えを制御していることが考えられる。IL-7はT細胞においてSTAT5を活性化する。さらにTCR 鎖遺伝子のエンハンサーにSTAT5結合部位が存在する。従ってIL-7Rからのシグナル伝達においてSTAT5がTCR 鎖遺伝子のエンハンサーにSTAT5結合部位が存在する。従ってIL-7Rからのシグナル伝達においてSTAT5がTCR 鎖特異的なV-J組み換え制御に関与していることが考えられる。 鎖特異的なV-J組み換え制御に関与していることが考えられる。 IL-7R欠損マウスはサイトカインおよびサイトカインレセプター欠損マウスの中でもリンパ球の初期分化の障害、特に 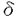 T細胞の消失が明瞭に認められる数少ないマウスである。従ってこのマウスと変異IL-7Rや T細胞の消失が明瞭に認められる数少ないマウスである。従ってこのマウスと変異IL-7Rや 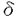 TCRトランスジェニックマウスとを交配することによりIL-7Rの生体内における機能を詳細に解析することが期待される。また本研究によりIL-7RからのシグナルがTCR TCRトランスジェニックマウスとを交配することによりIL-7Rの生体内における機能を詳細に解析することが期待される。また本研究によりIL-7RからのシグナルがTCR 鎖遺伝子特異的なV-J組み換えに必須であることが明らかになったが、この成果はTCR 鎖遺伝子特異的なV-J組み換えに必須であることが明らかになったが、この成果はTCR 遺伝子座のみならず他の抗原レセプター遺伝子の高次組み換え機構を解明する糸口になると思われる。 遺伝子座のみならず他の抗原レセプター遺伝子の高次組み換え機構を解明する糸口になると思われる。 |