赤痢菌によって引き起こされる細菌性赤痢は、主要な下痢症の一つとして発展途上国では今も乳幼児を中心に年間40-50万人の死者を数え、公衆衛生上依然大きな問題となっている。本菌はグラム陰性菌の一つでA-D群の4亜群からなり、腸管組織侵入性大腸菌(Enteroinvasive Escherichia coli,EIEC)と共に赤痢を惹起する。赤痢菌は腸管下部に到達後、大腸の上皮細胞と接触し菌自ら細胞内へ侵入する。細胞内で赤痢菌は活発に分裂、運動しつつ隣接上皮細胞へ漸次感染を行い、これを通じて上皮細胞は変性剥離し腸管に炎症、潰瘍を誘起し最終的に血性下痢を惹起する。本菌の細胞侵入から拡散に至る過程は、(i)上皮細胞への接着による侵入性蛋白の放出、(ii)エンドサイトーシスの誘発、(iii)ファゴゾームからの脱離、(iv)アクチン重合を利用した菌の運動、(v)隣接細胞への拡散からなり、この一連の感染過程は菌と宿主細胞の複雑な相互作用により進行すると考えられている。 上皮細胞へ侵入した赤痢菌の一極には、アクチンの重合と凝集によるコメット状の凝集束が形成される。この凝集束を形成する過程で、赤痢菌は菌体表面付近で生ずるアクチン重合により相対的に押し出されるように前進し、これを細胞内運動の原動力としている。このF(filamentous)-アクチンの凝集束形成には、赤痢菌が保有する大プラスミド上のvirG遺伝子が必要である。VirG蛋白は菌体表層上に分泌すると共に、菌体の分裂隔壁とは反対側の一極に局在する。同じ部位にF-アクチンの凝集束が形成されることから本蛋白はアクチンの重合・凝集に決定的な役割を果たしていると考えられている。しかしながら、このVirG蛋白の菌体表層分泌機構や、菌体上での局在、およびアクチンの重合・凝集の分子機構は明らかになっていない。 そこで本研究では赤痢菌のアクチン重合・凝集にもとづく細胞内・細胞間運動のメカニズムを明らかにすることを究極の目的として、(i)VirG蛋白の菌体表層分泌機構の解析、および(ii)VirG蛋白機能領域の解析と(iii)宿主細胞側のVirG結合因子の同定、を行い以下のような知見を得た。 (i)VirG蛋白の菌体表層分泌機構 VirGは、1102個のアミノ酸で構成される外膜蛋白で、シグナルペプチド(Met1-Ala52)、80kDa菌体外露出領域(Thr53-Arg758)、37kDa外膜貫通領域(Arg759-Phe1102)の3つの部分から構成される。VirGの80kDa領域が菌体外へ分泌する際に37kDa領域がどのような役割を果たしているのかを調べるために、AMPHI膜蛋白二次構造予測プログラム(AMPHI program)を用いて37kDa領域を構成する344アミノ酸の二次構造を予測し、その構造的な特性を解析した。その結果、11個の両親媒性膜貫通型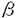 鎖と4個の膜貫通領域と思われる配列が認められたことから、この37kDa領域(VirG 鎖と4個の膜貫通領域と思われる配列が認められたことから、この37kDa領域(VirG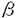 -コアと命名)は -コアと命名)は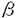 -バレル(樽形)と呼ばれる特殊な外膜貫通型チャンネル構造をとり、このVirG -バレル(樽形)と呼ばれる特殊な外膜貫通型チャンネル構造をとり、このVirG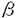 -コア自身がN-末端側80kDa領域(VirG -コア自身がN-末端側80kDa領域(VirG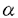 -ドメインと命名)を菌体外へ転移分泌する機能を有していることが示唆された。これを証明するために、大腸菌K-12株のペリプラズム蛋白MalE(マルトース結合蛋白)をVirG -ドメインと命名)を菌体外へ転移分泌する機能を有していることが示唆された。これを証明するために、大腸菌K-12株のペリプラズム蛋白MalE(マルトース結合蛋白)をVirG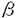 -コアのN-末端に連結した融合蛋白発現系を作成し、MalEの菌体表層分泌の有無を解析した。その結果、MalEはペリプラズムから菌体表面へ転移分泌されることが示された。また菌体外輸送機能に必要なVirG -コアのN-末端に連結した融合蛋白発現系を作成し、MalEの菌体表層分泌の有無を解析した。その結果、MalEはペリプラズムから菌体表面へ転移分泌されることが示された。また菌体外輸送機能に必要なVirG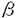 -コア最小領域を求めるため、VirG -コア最小領域を求めるため、VirG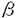 -コアのN-末端側を順次欠失させた4種類の -コアのN-末端側を順次欠失させた4種類の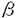 -コアを作成し、同様にMalEとの融合蛋白を発現させることによりMalEの菌体表層分泌能を解析した結果、菌体外分泌能に必要な領域はVirG -コアを作成し、同様にMalEとの融合蛋白を発現させることによりMalEの菌体表層分泌能を解析した結果、菌体外分泌能に必要な領域はVirG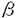 -コアのTyr801からPhe1102であることが示唆された。次にVirG -コアのTyr801からPhe1102であることが示唆された。次にVirG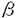 -コアを介して分泌される蛋白の折りたたみ構造(フォールディング)がVirG -コアを介して分泌される蛋白の折りたたみ構造(フォールディング)がVirG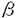 -コア通過にいかなる影響を与えるかを検討した。PhoA(アルカリフォスファターゼ)はペリプラズム蛋白で分子内に2つのジスルフィド結合を形成する。そこでVirG -コア通過にいかなる影響を与えるかを検討した。PhoA(アルカリフォスファターゼ)はペリプラズム蛋白で分子内に2つのジスルフィド結合を形成する。そこでVirG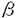 -コアのN-末端側にPhoAを連結し、PhoAの菌体表層分泌能を解析した。その結果、菌を通常の培地で培養した場合にはPhoAは菌体外へ分泌されず、一方、培地中に2-メルカプトエタノールを添加するか、あるいは菌にdsbA::Tn5変異を導入し、ペリプラズム中のPhoA分子内ジスルフィド結合の形成を阻害すると、PhoAの菌体外への発現量は顕著に増大した。すなわちVirG -コアのN-末端側にPhoAを連結し、PhoAの菌体表層分泌能を解析した。その結果、菌を通常の培地で培養した場合にはPhoAは菌体外へ分泌されず、一方、培地中に2-メルカプトエタノールを添加するか、あるいは菌にdsbA::Tn5変異を導入し、ペリプラズム中のPhoA分子内ジスルフィド結合の形成を阻害すると、PhoAの菌体外への発現量は顕著に増大した。すなわちVirG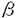 -コアによる菌体外輸送機構には、ペリプラズムでのPhoA分子内ジスルフィド結合の解離が必要であり、おそらく折りたたみ構造が解離した形状(アンフォールド)であれば -コアによる菌体外輸送機構には、ペリプラズムでのPhoA分子内ジスルフィド結合の解離が必要であり、おそらく折りたたみ構造が解離した形状(アンフォールド)であれば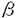 -バレル内を通過できることが示唆された。以上の結果から、VirGは -バレル内を通過できることが示唆された。以上の結果から、VirGは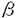 -コアによって -コアによって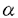 -ドメインをペリプラズムから菌体外へ転移分泌するという自己輸送蛋白であると同時に、淋菌(Neisseria gonorrhoeae)のIgAプロテアーゼの輸送系と類似する分子機構を持つと考えられた。 -ドメインをペリプラズムから菌体外へ転移分泌するという自己輸送蛋白であると同時に、淋菌(Neisseria gonorrhoeae)のIgAプロテアーゼの輸送系と類似する分子機構を持つと考えられた。 (ii)VirG蛋白機能領域の解析 感染細胞内でのアクチン重合・凝集機構に関与するVirG機能領域を同定する目的で、菌体外露出領域VirG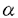 -ドメインを一部欠失させた種々の変異VirGの発現系を作成し、各々の変異VirGの菌体表層一極発現および感染細胞内でのF-アクチン凝集束形成能を解析した。その結果、 -ドメインを一部欠失させた種々の変異VirGの発現系を作成し、各々の変異VirGの菌体表層一極発現および感染細胞内でのF-アクチン凝集束形成能を解析した。その結果、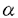 -ドメインには感染細胞内でのアクチン重合・凝集に必要な領域(グリシン残基の豊富な8つの繰り返し配列を含む)と、VirGの菌体一極発現に必要な領域、の2つの異なる機能領域が存在することが示唆された。一方、細胞接着斑形成に重要な蛋白の1つであるビンキュリンが感染細胞内の菌表面のVirG局在部位に凝集することが認められた。種々の変異VirG発現株を用いて菌体へのビンキュリン凝集に関与するVirG -ドメインには感染細胞内でのアクチン重合・凝集に必要な領域(グリシン残基の豊富な8つの繰り返し配列を含む)と、VirGの菌体一極発現に必要な領域、の2つの異なる機能領域が存在することが示唆された。一方、細胞接着斑形成に重要な蛋白の1つであるビンキュリンが感染細胞内の菌表面のVirG局在部位に凝集することが認められた。種々の変異VirG発現株を用いて菌体へのビンキュリン凝集に関与するVirG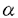 -ドメイン領域を調べた結果、 -ドメイン領域を調べた結果、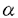 -ドメインのアクチン重合・凝集に必要な領域はビンキュリンの凝集にも関与していること、さらにビンキュリンはアクチンの凝集に先立って菌体のVirG局在部位に凝集することが示唆された。したがってVirGはアクチンの重合・凝集を引き起こす前に、ビンキュリンとの間で何らかの相互作用を引き起こしていると推定された。 -ドメインのアクチン重合・凝集に必要な領域はビンキュリンの凝集にも関与していること、さらにビンキュリンはアクチンの凝集に先立って菌体のVirG局在部位に凝集することが示唆された。したがってVirGはアクチンの重合・凝集を引き起こす前に、ビンキュリンとの間で何らかの相互作用を引き起こしていると推定された。 (iii)宿主細胞側のVirG結合因子の同定 VirGとビンキュリンの相互作用を明らかにする目的で、グルタチオンS-トランスフェラーゼ(GST)とVirG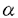 -ドメインの各種断片とを連結した融合蛋白を作成し、赤痢菌のアクチン重合・凝集のin vitro実験系として用いられるアフリカツメガエル卵母細胞抽出液や、ニワトリ砂嚢より精製したビンキュリンを用い、in vitroの条件下で種々のGST-VirG -ドメインの各種断片とを連結した融合蛋白を作成し、赤痢菌のアクチン重合・凝集のin vitro実験系として用いられるアフリカツメガエル卵母細胞抽出液や、ニワトリ砂嚢より精製したビンキュリンを用い、in vitroの条件下で種々のGST-VirG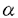 -ドメインとビンキュリンとの結合の有無を検討した。その結果、 -ドメインとビンキュリンとの結合の有無を検討した。その結果、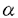 -ドメインのアクチン重合・凝集に必要な領域がビンキュリンに直接結合することが示された。またStaphylococcus aureus V8プロテアーゼを用いてビンキュリンを95kDa頭部および30kDa尾部に分離精製し、同様にGST-VirG -ドメインのアクチン重合・凝集に必要な領域がビンキュリンに直接結合することが示された。またStaphylococcus aureus V8プロテアーゼを用いてビンキュリンを95kDa頭部および30kDa尾部に分離精製し、同様にGST-VirG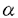 -ドメインとの結合実験を行った結果、ビンキュリンのGST- -ドメインとの結合実験を行った結果、ビンキュリンのGST-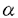 -ドメイン結合領域は95kDa頭部にあることが示された。さらに放射標識したビンキュリンとの定量的な結合実験の結果、GST-VirG -ドメイン結合領域は95kDa頭部にあることが示された。さらに放射標識したビンキュリンとの定量的な結合実験の結果、GST-VirG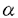 -ドメインは117kDa全長ビンキュリンに対する結合に比べ、30kDa尾部を除去した95kDa頭部に対してより強く結合することが示された(117kDa全長蛋白とのKd値は1000nM以上であったのに対し、95kDa頭部とのKd値は約300nM)。したがってビンキュリンの95kDa頭部-30kDa尾部間の分子内相互作用がVirG -ドメインは117kDa全長ビンキュリンに対する結合に比べ、30kDa尾部を除去した95kDa頭部に対してより強く結合することが示された(117kDa全長蛋白とのKd値は1000nM以上であったのに対し、95kDa頭部とのKd値は約300nM)。したがってビンキュリンの95kDa頭部-30kDa尾部間の分子内相互作用がVirG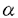 -ドメインとの結合を制御している可能性が示唆された。一方、ビンキュリンがVirGによるアクチン重合・凝集に必要かどうか調べるために、免疫沈降によってアフリカツメガエル卵母細胞抽出液よりビンキュリンを除去後、F-アクチン凝集束形成の有無を検討した結果、ビンキュリン除去によりF-アクチン凝集率が約1/3に低下し、さらにニワトリビンキュリンを添加することによって約80%まで回復した。したがってVirGによるアクチン凝集・重合にはVirGとビンキュリンの結合が不可欠であることが明らかになった。 -ドメインとの結合を制御している可能性が示唆された。一方、ビンキュリンがVirGによるアクチン重合・凝集に必要かどうか調べるために、免疫沈降によってアフリカツメガエル卵母細胞抽出液よりビンキュリンを除去後、F-アクチン凝集束形成の有無を検討した結果、ビンキュリン除去によりF-アクチン凝集率が約1/3に低下し、さらにニワトリビンキュリンを添加することによって約80%まで回復した。したがってVirGによるアクチン凝集・重合にはVirGとビンキュリンの結合が不可欠であることが明らかになった。 ビンキュリンは細胞接着斑において、テーリン、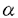 -アクチニン、F-アクチン、テンシンといった蛋白間を架橋するとともに、パキシリン、Ptdlns(4,5)P2といったシグナル伝達分子とも結合して、アクチンの再構成に必須な役割を担っている。また最近、VASP(vasodilator-stimulated phosphoprotein)と呼ばれる蛋白がアクチン重合のモジュレーターの1つであるプロフィリンと結合することが報告され、このVASPがビンキュリンとも結合できることが示唆されている。したがって本研究で明らかにされたVirGとビンキュリンの結合をきっかけとして、おそらく菌体の一極にF-アクチンやアクチン重合制御蛋白の集合を引き起こし、最終的にアクチンの重合・凝集が菌の一極から進行するという可能性が示唆された。 -アクチニン、F-アクチン、テンシンといった蛋白間を架橋するとともに、パキシリン、Ptdlns(4,5)P2といったシグナル伝達分子とも結合して、アクチンの再構成に必須な役割を担っている。また最近、VASP(vasodilator-stimulated phosphoprotein)と呼ばれる蛋白がアクチン重合のモジュレーターの1つであるプロフィリンと結合することが報告され、このVASPがビンキュリンとも結合できることが示唆されている。したがって本研究で明らかにされたVirGとビンキュリンの結合をきっかけとして、おそらく菌体の一極にF-アクチンやアクチン重合制御蛋白の集合を引き起こし、最終的にアクチンの重合・凝集が菌の一極から進行するという可能性が示唆された。 |