学位論文要旨
| No | 112793 | |
| 著者(漢字) | 度会,雅久 | |
| 著者(英字) | ||
| 著者(カナ) | ワタライ,マサヒサ | |
| 標題(和) | 赤痢菌の上皮細胞侵入機構に関する細胞生物学的研究 | |
| 標題(洋) | ||
| 報告番号 | 112793 | |
| 報告番号 | 甲12793 | |
| 学位授与日 | 1997.03.28 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(医学) | |
| 学位記番号 | 博医第1163号 | |
| 研究科 | 医学系研究科 | |
| 専攻 | 病因・病理学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | 赤痢菌は細胞侵入性細菌の一つで、結腸において孤立リンパ小節のM細胞に取り込まれ、マクロファージに貪食されるが、マクロファージにアポトーシスを誘導し、腸上皮細胞の基底膜側に離脱する。次いで腸上皮細胞の側底面側から細胞内へ侵入後、増殖・拡散し、細胞間感染を行い、これを通じて腸管組織に潰瘍・炎症を誘起し最終的に血性下痢を惹起する。ビルレンス機能は赤痢菌の有する230kbのプラスミド上に存在し、細胞侵入に係わる機能は3つの分泌性蛋白質、IpaB,IpaC,IpaD(invasion plasmid antigens)にコードされ、またIpa蛋白質の分泌は同じプラスミド上のmxi(membrane expression of invasion plasmid antigens)とspa(surface presentation of invasion plasmid antigens)の遺伝子群にコードされている。したがって、本菌の感染過程には菌と宿主細胞の様々な機能が関与し、それらの複雑な相互作用により最終的に感染が成立すると考えられる。しかしながら、これらの病原因子と宿主細胞との相互作用については不明な点が多い。そこで本研究では赤痢菌の上皮細胞侵入機構を明らかにする目的で、以下の5つの点に関して解析を行った。(i)赤痢菌の上皮細胞側底面からの侵入性とIpa蛋白質の菌体分泌と遊離の関係、(ii)Ipa蛋白質の菌体表層からの遊離とSpa32蛋白質の外膜発現、(iii)Ipa蛋白質の上皮細胞レセプターの同定、(iv)赤痢菌の細胞侵入とシグナル伝達、(v)その調節、について解析を行い以下の結果を得た。 (i):Ipa蛋白質はMxi-Spa蛋白質分泌系を介して、一旦菌体表層へ分泌発現するが、菌を上皮細胞へ接触させるとIpa蛋白質は速やかに(5分以内)培養液中へ遊離する。本現象は菌を極性化したCaco-2細胞に感染させた場合にも同様に認められた。すなわち、遊離したIpa蛋白質の量は菌を頂端側よりも側底面側と接触させた方が高く、また菌の細胞侵入効率も頂端側と比べ側底面側の方が著しく高いことが明らかとなった。さらに、赤痢菌をフィブロネクチン、ラミニン、IV型コラーゲンと接触させると、Ipa蛋白質が菌体から速やかに遊離することを認めた。したがって、Ipa蛋白質の菌体からの遊離は赤痢菌の細胞侵入部位で特異的に起こる現象であることが示唆された。 (ii):Ipa蛋白質の菌体表層から培養液中への遊離が赤痢菌の細胞侵入に不可欠であるか否か不明確であったが、本現象に係わる遺伝子の変異株を単離し、それを利用してIpa蛋白質の遊離が菌の細胞侵入に必須であることを示した。すなわち、spaオペロン上にあるspa32遺伝子変異株では、親株とほぼ同じレベルのIpa蛋白質が菌体表層に分泌されているにもかかわらず、細胞侵入効率は親株の十分の一以下へと低下し、さらに菌を上皮細胞に接触させてもIpa蛋白質の遊離は認められなかった。 (iii):赤痢菌は上皮細胞と接触するとエンドサイトーシスを誘発し細胞へ侵入する。これはIpa蛋白質が仮想レセプターと相互作用する結果引き起こされると考えられるがそのレセプターはまだ同定されていない。また赤痢菌は接着斑と呼ばれる細胞と基質(細胞外マトリックス)との接着部位から侵入することが知られている。そこで接着斑で機能している細胞接着因子の一つであるインテグリンに着目し、Chinese hamster ovary(CHO)細胞を用いて赤痢菌の細胞侵入時におけるIpa蛋白質と (iv):(iii)の結果から、赤痢菌の上皮細胞侵入に伴い、 (v):インテグリンを介したシグナル伝達は細胞接着やストレス線維形成、細胞質分裂、細胞運動、細胞増殖などの重要な機能に関係する。そこで、ras類似低分子量GTP結合蛋白質であるRho蛋白質の赤痢菌感染における役割を検討した。Rho蛋白質はボツリヌス菌が産生するC3酵素によってADPリボシル化されその活性を失う。C3酵素で処理した細胞における赤痢菌の感染効率を調べた結果、その感染効率は十分の一以下へと低下した。一方、Rho蛋白質の14番目のアミノ酸であるグリシンをバリンに変異させた活性型Rho蛋白質を精製し、この活性型Rho蛋白質を上皮細胞の細胞質内にマイクロインジェクションすると赤痢菌の感染効率が5〜6倍上昇した。また、C3酵素で上皮細胞を処理することにより、赤痢菌と細胞の接触部位に出現したF-アクチン、ビンキュリン、テーリンの凝集は阻害され、またFAKとパキシリンのチロシンリン酸化も阻害された。これら赤痢菌の細胞侵入に伴って引き起こされる細胞内シグナルは同様に遊離したIpa蛋白質を上皮細胞に加えることによっても誘導され、それはC3酵素処理で遮断された。これらの結果から、赤痢菌の上皮細胞侵入により誘導されるエンドサイトーシスはRho蛋白質依存性のシグナル伝達により制御されていることが強く示唆された。 以上の結果から赤痢菌の細胞侵入はIpa蛋白質とインテグリンの結合を引き金として、上皮細胞内にシグナルが惹起され、これにより細胞接着因子の凝集と細胞骨格系蛋白質の再構成が生じ、菌を細胞質へ取り込むことが本研究により示唆された。 | |
| 審査要旨 | 本研究は赤痢菌の上皮細胞侵入機構を明らかにするため、赤痢菌を培養細胞へ感染させる系にて、赤痢菌の病原因子と宿主細胞との相互作用の解析を試みたものであり、下記の結果を得ている。 1.Ipa蛋白質はMxi-Spa蛋白質分泌系を介して、一旦菌体表層へ分泌発現するが、菌が上皮細胞に接触すると菌はIpa蛋白質を速やかに(5分以内)培養液中へ遊離する。菌を極性化したCaco-2細胞に感染させた場合には、遊離したIpa蛋白質の量は菌を頂端側よりも側底面側と接触させた方が高く、また菌の細胞侵入効率も頂端側と比べ側底面側の方が著しく高かった。さらに、赤痢菌をフィブロネクチン、ラミニン、IV型コラーゲンと接触させても、Ipa蛋白質は菌体から速やかに遊離することを認めた。おそらくIpa蛋白質の菌体からの遊離は赤痢菌の細胞侵入部位で特異的に起こる現象であると思われる。 2.これまでIpa蛋白質の菌体表層から培養液中への遊離が赤痢菌の細胞侵入に不可欠であるか否か不明確であったが、本現象に係わる遺伝子の変異株を単離し、それを利用してIpa蛋白質の遊離が菌の細胞侵入に必須であることを示した。すなわち菌を上皮細胞に接触させてもIpa蛋白質の遊離をしないspa32遺伝子変異株では、親株とほぼ同じレベルのIpa蛋白質を菌体表層に発現しているにもかかわらず、細胞侵入効率は親株の十分の一以下へと低下した。 3.Ipa蛋白質のレセプターを検索する目的で、細胞接着因子の一つであるインテグリンに着目し、Chinese hamster ovary(CHO)細胞を用いて赤痢菌の細胞侵入時におけるIpa蛋白質と 4.3の結果から、赤痢菌の上皮細胞侵入に伴い、インテグリンを介したシグナル伝達が関与している可能性が考えられた。そこで細胞侵入部位を共焦点レーザー顕微鏡を用いて解析したところ、菌と細胞の接触部位に見られるF-アクチンの重合と同時にインテグリンさらにその部位にはビンキュリン、テーリンが局在化することが分かった。一方赤痢菌のCHO細胞への感染に伴ってfocal adhesion kinase(FAK)とパキシリンのチロシンリン酸化が促進されることを認めた。これらの結果から、赤痢菌の細胞侵入時に菌体表層から遊離したIpa蛋白質はインテグリンに結合し、インテグリンを介したシグナル伝達および細胞骨格の再構成を引き起こし、これによって赤痢菌が上皮細胞に侵入するものと考えられた。 5.ras類似低分子量GTP結合蛋白質であるRho蛋白質の赤痢菌感染における役割を検討する目的で、C3酵素で処理した細胞における赤痢菌の感染効率を調べた結果、その感染効率は十分の一以下へと低下した。一方、活性型Rho蛋白質を上皮細胞の細胞質内にマイクロインジェクションすると赤痢菌の感染効率が5〜6倍上昇した。また、C3酵素で上皮細胞を処理することにより、赤痢菌と細胞の接触部位に出現したF-アクチン、ビンキュリン、テーリンの凝集は阻害され、またFAKとパキシリンのチロシンリン酸化も阻害された。これら赤痢菌の細胞侵入に伴って引き起こされる細胞内シグナルは遊離したIpa蛋白質を上皮細胞に加えることによっても誘導され、それはC3酵素処理で遮断された。これらの結果から、赤痢菌の上皮細胞侵入により誘導されるエンドサイトーシスはRho蛋白質依存性のシグナル伝達により制御されていることが強く示唆された。 以上、本論文における研究では赤痢菌の上皮細胞侵入において、菌と宿主細胞の相互作用の解析から、Ipa蛋白質遊離とその細胞侵入における役割の解明とIpa蛋白質に対する宿主細胞側レセプターの同定を行っている。本研究はこれまで不明な点が多かった赤痢菌の感染過程における分子応答機構の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54588 |
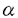 5
5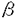 1インテグリン(フィブロネクチンレセプター)の相互作用について解析した。赤痢菌の細胞侵入率はインテグリンの発現量に比例して上昇した。赤痢菌の細胞侵入時にIpa蛋白質複合体形成と、さらにIpa蛋白質複合体が
1インテグリン(フィブロネクチンレセプター)の相互作用について解析した。赤痢菌の細胞侵入率はインテグリンの発現量に比例して上昇した。赤痢菌の細胞侵入時にIpa蛋白質複合体形成と、さらにIpa蛋白質複合体が