本研究ではシトクロムb558の種々の部位に対応するペプチドを合成し、その無細胞系におけるスーパーオキシド産生への影響を検討することにより、そのドメインの役割を明らかにすると共に、シトクロムのトポロジーについても考察して、下記の結果を得ている。 1。小鎖の機能ドメインについて:His-94近傍の役割 His-94が関与する小鎖の82から95番目に対応するペプチド、PFTRNYYVRAVLHLを合成し、形質膜と細胞質画分からなる無細胞系スーパーオキシド産生系への影響を調べた。その結果、このペプチドは加えた量に比例してスーパーオキシド産生を阻害すること、このペプチドは系のSDSによる活性化に先だって加えた場合にのみ活性を阻害することが明らかになった(IC50=13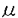 M)。またこの14残基のアミノ酸をC末端とN末端側から順次削ったペプチドを合成して検討した結果、IC50=50 M)。またこの14残基のアミノ酸をC末端とN末端側から順次削ったペプチドを合成して検討した結果、IC50=50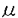 M以下の活性を示す最小単位はTRNYYVRAVLであった。また各アミノ酸をアラニンで置換したペプチドを使って検討したところ、YYV部分が重要であり、細胞質構成蛋白質が形質膜に移動するのを阻害することが明らかになった。 M以下の活性を示す最小単位はTRNYYVRAVLであった。また各アミノ酸をアラニンで置換したペプチドを使って検討したところ、YYV部分が重要であり、細胞質構成蛋白質が形質膜に移動するのを阻害することが明らかになった。 2。大鎖の機能ドメインについて:親水性部位の役割と大鎖のトポロジー シトクロム大鎖のアミノ酸配列の計算から、親水性の部位12カ所の部分を決定し、6ヶ所の部位のアミノ酸配列に相当するペプチドが活性を阻害することを見いだした。これらの部位は既に報告のあるカルボキシル末端部位とアミノ酸77-93の部位を除けば、今までに報告のない部位であった。いずれのペプチドも系を活性化する前に加えた場合にのみ阻害活性を示したことから、シトクロムと細胞質性構成蛋白質との相互作用に関与していること、これらの部位はいずれもが細胞質に曝されている部位であると考えられた。 3。アミノ酸配列の親水性疎水性と以上の結果を考慮に入れてシトクロムの大鎖のトポロジーを推定したが、細胞質に張り出していると考えられた部位はアミノ末端に近い2ヶ所のループ、27-46及び87-100、親水性の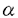 helixからなる304-321およびこれに隣接する282-296、NADPH結合部位の一つ434-455およびカルボキシル末端に近い559-565であった。 helixからなる304-321およびこれに隣接する282-296、NADPH結合部位の一つ434-455およびカルボキシル末端に近い559-565であった。 4。阻害のかかった6ヶ所の部位に相当するペプチドが、刺激により細胞質構成蛋白質が形質膜に移動を阻害を調べたところ、4ヶ所の部位に相当するペプチドがこの移動を阻害することが明らかになった。これらの部位の内、1カ所は既に報告のあるカルボキシル末端に近い559-565であったが、他の3ヶ所(27-46,87-100,434-455)は今回初めて移動の阻害が明らかになった部位であり、ペプチドによりp47-phox及びp67-phoxの移動に対する阻害の程度が異なることで、シトクロムはp47-phoxと種々の部位で結合しているだけでなく、p67-phoxとも幾つかの部位で結合していると考えられた。 5。これら細胞質性構成蛋白質の膜への移動に対する阻害と、スーパーオキシド産生活性に対する阻害の関係を調べたところ、27-46に相当するのペプチド以外は両阻害活性がほぼ一致しており、活性の阻害の原因がシトクロムと細胞質性蛋白質の結合阻害にあると考えられた。27-46に相当するペプチドは細胞質蛋白質の膜への移動は部分的にしか阻害しないが、活性は完全に阻害していた。おそらくペプチドはシトクロムと細胞質性構成蛋白質の間に介在して、活性を阻害しているものと考えられる。移動を阻害しないその他のペプチドも同様の機構で活性を阻害しているものと推定された。 以上のように本論文は好中球のシトクロムb558の大小鎖の種々の部位がスーパーオキシド産生系においてその活性化に重要な役割をはたしていることを明らかにすると共に、シトクロムの膜上でのトポロジーについても言及したものである。好中球の活性酸素産生機構を知る上で重要な貢献をなすものであり、学位の授与に値するものと考えられる。 |