学位論文要旨
| No | 112810 | |
| 著者(漢字) | 絹川,弘一郎 | |
| 著者(英字) | ||
| 著者(カナ) | キヌガワ,コウイチロウ | |
| 標題(和) | 心筋細胞における誘導型NO合成酵素の発現調節とその機能的意義 | |
| 標題(洋) | ||
| 報告番号 | 112810 | |
| 報告番号 | 甲12810 | |
| 学位授与日 | 1997.03.28 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(医学) | |
| 学位記番号 | 博医第1180号 | |
| 研究科 | 医学系研究科 | |
| 専攻 | 内科学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | この研究の前半部において誘導型NO合成酵素(iNOS)を心筋細胞に誘導し,その産生するNOの心筋における直接作用を細胞収縮と細胞内Ca2+濃度の同時測定により検討した.新生仔および成ラットの心筋細胞において、interleukin(IL)-6とtumornecrosis factor(TNF) われわれは以前にcytokineの1つであるIL-6がニワトリ胚培養心筋細胞において急性に心筋収縮抑制作用を有することを報告した.また、その細胞内機序はIL-6による構成型NO合成酵素の活性化による一過性のNO-cGMP産生の増加によると考えられた.このことと上記のiNOSの誘導とを考え併せると、cytokineは急性的にも慢性的にも心筋収縮能に対して抑制的に働き、心筋細胞内のCa2+handlingを変化させ、さらには収縮蛋白のCa2+感受性の低下をもたらす可能性のあることが示唆された.近年、拡張型心筋症や移植後拒絶心などの病的心におけるiNOSの発現が報告されている.すなわち、一般の心不全その他の心筋収縮力が低下した低下している病態にiNOSの関与が考えられる.さらにiNOSをknock outされたマウスにおいて、LPS challengeによるshock responseが消失しており、いわゆるseptic shockの原因がiNOSであることを強く示唆する.このshockから死に至る経過において全身の血管抵抗の低下による血圧の低下が重要なfactorであるとされてきたが、この研究によれば、心筋自体の収縮力低下によるpump failureの要素も十分考えられる.また、septic shockの治療の点ではiNOSをtargetにしたNG-monomethyl-L-arginineの投与も有用であると思われる. 後半部においてはiNOS発現に関わる細胞内情報伝達経路の検討を行った.LPSによるiNOSのmRNAレベルでの発現にはIL-6、TNF 心不全治療においては、cathecholamineやphosphodiesterase阻害剤の投与は長期予後の改善にはつながらないと考えられている.このことはcAMPによるiNOS発現の促進作用もその機序の一部となっている可能性がある.iNOSの誘導にはfree radicalを介する経路も存在し、虚血再潅流傷害などの病態においてもiNOSが関与している可能性が考えられる. | |
| 審査要旨 | 本研究は心筋細胞に誘導されたNO合成酵素(iNOS)の機能的意義とその発現調節につき検討したものであり、主として新生仔ラットの培養心筋細胞において、下記の結果を得ている. 1.新生仔ラットの培養心筋細胞において、interleukin(IL)-6とtumor necrosis factor(TNF) 2.NG-monomethyl-L-arginine前投与によるNOS抑制下にiNOSを発現させた新生仔ラット心筋細胞において、過剰量のL-arginineを投与すると、陰性変力作用、陰性変時作用、細胞内Ca2+濃度減少作用、拡張期細胞位置の下方移動を生じた.即ち、cytokineやLPSはiNOSの誘導を介して心筋抑制作用を呈する可能性が示唆された.さらに上記の心筋抑制作用はcGMP依存性protein kinaseの阻害薬であるKT5823により有意に抑制され、このiNOSの産生するNOによる心筋抑制作用はcGMP依存性protein kinaseの活性化によるものが大きいと考えられた。 3.LPSによるiNOSのmRNAレベルでの発現にはIL-6、TNF 4.これらの複雑な転写調節機構を説明する手がかりとしてラットiNOSの5’上流領域を1111塩基対cloningした.iNOS遺伝子の5’上流領域1-kbにはNF- 5.このcloningされた5’上流領域を使用してchloramphenicol acetyltransferaseをreporter geneとして施行した転写活性の測定によれば、GASおよびIRF結合部位の存在するenhancer領域(-1045〜-893)とNF- 6.DNase I foot printing assayによれば上記の部分にLPSにより誘導されるDNA結合蛋白の存在を認めた.Electrophoretic mobility shift assayにより、LPSまたはTNF 以上、本論文は心筋細胞におけるiNOSの機能的意義とその発現調節について明らかにした.本研究はiNOSの心筋細胞の機能に及ぼす影響を細胞内Ca動態を含めて検討した最初のものである.また、これまで指摘されてきた複雑なiNOSの転写調節機構に関して重要な示唆を与える知見を含んでおり、あわせて学位の授与に値するものと考えられる. | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54589 |
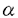 の同時投与またはlipopolysaccharide(LPS)投与により、iNOSがmRNAおよび蛋白レベルで時間依存的に誘導された.免疫染色によると、新生仔および成ラットの心線維芽細胞におけるLPSによるiNOSの誘導はごくわずかであった.また、iNOSの誘導により、培養上清中のNO産生と心筋細胞内cGMP含量が有意に増加した.誘導されたNOS活性はCa2+非依存性であり、これまで報告されているiNOSの特徴に合致した.LPS投与により、心筋細胞のviabilityは有意な変化を受けなかった.NG-monomethyl-L-arginine前投与によるNOS抑制下にiNOSを発現させた新生仔ラット心筋細胞において、過剰量のL-arginineを投与すると、陰性変力作用、陰性変時作用、細胞内Ca2+濃度減少作用、拡張期細胞位置の下方移動を生じた.即ち、cytokineやLPSはiNOSの誘導を介して心筋抑制作用を呈する可能性が示唆された.さらにこのiNOSの誘導された心筋細胞においてcAMPの変化はなく、上記の心筋抑制作用はcGMP依存性protein kinaseの阻害薬であるKT5823により有意に抑制された.したがって、このiNOSの産生するNOによる心筋抑制作用はphosphodiesteraseの活性化および抑制による機序よりもcGMP依存性protein kinaseの活性化によるものが大きいと考えられた.
の同時投与またはlipopolysaccharide(LPS)投与により、iNOSがmRNAおよび蛋白レベルで時間依存的に誘導された.免疫染色によると、新生仔および成ラットの心線維芽細胞におけるLPSによるiNOSの誘導はごくわずかであった.また、iNOSの誘導により、培養上清中のNO産生と心筋細胞内cGMP含量が有意に増加した.誘導されたNOS活性はCa2+非依存性であり、これまで報告されているiNOSの特徴に合致した.LPS投与により、心筋細胞のviabilityは有意な変化を受けなかった.NG-monomethyl-L-arginine前投与によるNOS抑制下にiNOSを発現させた新生仔ラット心筋細胞において、過剰量のL-arginineを投与すると、陰性変力作用、陰性変時作用、細胞内Ca2+濃度減少作用、拡張期細胞位置の下方移動を生じた.即ち、cytokineやLPSはiNOSの誘導を介して心筋抑制作用を呈する可能性が示唆された.さらにこのiNOSの誘導された心筋細胞においてcAMPの変化はなく、上記の心筋抑制作用はcGMP依存性protein kinaseの阻害薬であるKT5823により有意に抑制された.したがって、このiNOSの産生するNOによる心筋抑制作用はphosphodiesteraseの活性化および抑制による機序よりもcGMP依存性protein kinaseの活性化によるものが大きいと考えられた.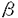 受容体刺激薬は促進的に、dexamethasone、cAMP依存性protein kinase阻害薬(H89)、tyrosine kinase阻害薬、free radical scavenger(pyrrolidine dithiocarbamate[PDTC])は抑制的に作用した.NO産生の程度もiNOS蛋白の発現もiNOSのmRNAレベルと平行して変化した.これらの複雑な転写調節機構を説明する手がかりとしてラットiNOSの5’上流領域のcloningをまず行った.ラットiNOSの5’上流領域を1111塩基対cloningし、その塩基配列を同定したところ、すでにcloningされていたマウスの5’上流領域と相同性の高い領域に転写因子結合部位が存在すると考えられた.iNOS遺伝子の5’上流領域1-kbにはNF-
受容体刺激薬は促進的に、dexamethasone、cAMP依存性protein kinase阻害薬(H89)、tyrosine kinase阻害薬、free radical scavenger(pyrrolidine dithiocarbamate[PDTC])は抑制的に作用した.NO産生の程度もiNOS蛋白の発現もiNOSのmRNAレベルと平行して変化した.これらの複雑な転写調節機構を説明する手がかりとしてラットiNOSの5’上流領域のcloningをまず行った.ラットiNOSの5’上流領域を1111塩基対cloningし、その塩基配列を同定したところ、すでにcloningされていたマウスの5’上流領域と相同性の高い領域に転写因子結合部位が存在すると考えられた.iNOS遺伝子の5’上流領域1-kbにはNF-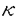 B結合部位、interferon regulatory factor(IRF)結合部位、CAAT配列、
B結合部位、interferon regulatory factor(IRF)結合部位、CAAT配列、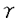 -interferon activation site(GAS)が存在する.このcloningされた5’上流領域を使用してchloramphenicol acetyltransferaseをreporter geneとして施行した転写活性の測定によれば、GASおよびIRF結合部位の存在するenhancer領域(-1045〜-893)とNF-
-interferon activation site(GAS)が存在する.このcloningされた5’上流領域を使用してchloramphenicol acetyltransferaseをreporter geneとして施行した転写活性の測定によれば、GASおよびIRF結合部位の存在するenhancer領域(-1045〜-893)とNF-