2.血管攣縮モデルの作成(血管攣縮急性実験) 5羽の体重2.5〜3.0kgの雄の家兎を用い、総頚動脈を直径2.5mmのPTCA用バルーンで2〜3回往復擦過し内皮細胞を剥離した。その後2%コレステロール食にて4週間飼育し内膜を再生させた。一方、左総頚動脈は内膜保存のままとした。血管攣縮誘発物質としては血管平滑筋細胞の遊走、増殖、血小板活性化などに対し影響の少ないものとしてPhenylephrineを用いた。また投与経路は総頚動脈局所のみに作用し全身的な影響を極力少なくするために、血管外膜周囲への局所投与とした。すなわちケタラール麻酔下に10-2M Phenylephrine0.4ccを、27ゲージ注射針にて経皮的に左右総頚動脈外膜周囲に局注した。血管攣縮の評価は、血管造影と超音波断層装置を用いて血管の内径を計測することにより定量的に行った。血管攣縮率は、(拡張時血管内径-攣縮時血管内径)/拡張時血管内径×100%とした。各群間の比較には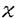 2検定を用い、p<0.05をもって有意差とした。
2検定を用い、p<0.05をもって有意差とした。
内膜再生;5羽の家兎の右総頚動脈の内皮細胞剥離後、2羽において直後に血管を摘出した。血管内皮細胞はすべて剥離されていた.この方法では内皮細胞は完全に剥離されるが、内弾性板以下の組織に傷害の発生は認められなかった。残りの3羽において2%コレステロール食にて4週間飼育後、血管を摘出した。内頚動脈は一層の内皮細胞が再生されていたが、血管平滑筋細胞の遊走や内膜肥厚は認められなかった。内弾性板にも断裂などの異常は認められなかった。
血管攣縮誘発;右総頚動脈内膜再生家兎4羽において10-2M Phenylephrine0.4ccを左右総頚動脈の血管外膜周囲に局注し、血管攣縮を誘発した。血管造影および超音波法での血管内径計測と血管攣縮率は以下の如くであった.
 図表
図表 左右総頚動脈の内径に有意差はなく、攣縮率は右総頚動脈で大きい傾向はあったが(造影法:64±7%vs57±5%、超音波法:61±6%vs55±4%)、有意差はなかった。造影法と超音波法の攣縮率の比較では超音波法でやや低く評価する傾向があったが(右総頚動脈:64±7%vs61±6%、左総頚動脈:57±5%vs55±4%)、有意差はなかった。血管攣縮は40分から60分持続した。そのうち攣縮率が50%を越えるような強い攣縮は約20分以上持続した。
3.血管攣縮慢性実験 家兎を以下の4群に分けた。
1)攣縮群(n=7):内膜再生した右総頚動脈を攣縮群とした。10-2M Phenylephrine0.4ccを右総頚動脈の血管外膜周囲に局注し、血管攣縮を誘発した。
2)攣縮抑制群(n=5):あらかじめ血管攣縮抑制剤を投与し攣縮を抑制した。ニトロール(ISDN)0.5mg静注、0.5mg筋注にて前処置後、10-2M Phenylephrine0.4ccを左右総頚動脈の血管外膜周囲に局注した。内膜再生した右総頚動脈を非攣縮群とした。
3)生食群(n=5):生理食塩水0.4ccを左右総頚動脈の血管外膜周囲に局注した。内膜再生した石総頚動脈を生食群とした。
4)内膜保存群(n=7):攣縮群の左総頚動脈を内膜保存群とした。10-2M Phenylephrine0.4ccを左総頚動脈の血管外膜周囲に局注し、血管攣縮を誘発した。各薬剤の局注は週3回、5週間、計15回施行した。
血管攣縮率;血管内径の計測は非侵襲的に繰り返して行えることより、超音波断層法にて行った。攣縮群の平均攣縮率は61±5%で、攣縮抑制群の36±8%(p<0.05)、生食群の-0.7±6%(p<0.001)に比し有意に高かった。一方、内膜保存群では平均攣縮率は53±7%で攣縮群と有意差を認めなかった。
内膜肥厚度;5週間、計15回の血管攣縮誘発後、総頚動脈を摘出し組織学的に検討した。面積の計測は血管横断面の顕微鏡写真(×100)上でプラニメーターを用いて行った。内膜肥厚度は、内膜面積/内弾性板内面積×100%として算出した。攣縮群では中膜平滑筋細胞の内膜への遊走と泡沫細胞の出現がみられ、著明な内膜肥厚が認められた。一方、攣縮抑制群、生食群、内膜保存群では、内膜肥厚は強く抑制されており、ごく一部に認められる程度であった。攣縮群の平均内膜肥厚度は55±10%で、非攣縮群の5±3%、生食群の4±1%、内膜保存群の3±2%に対し有意に高値であった(p<0.01)。
内弾性板の変化;平滑筋細胞の遊走は内弾性板の切れ目からまとまって遊走していた。そこで、内弾性板の断裂について検討した。断裂部の数は攣縮群では28.8±6.6、攣縮抑制群の6.4±1.7、生食群の2.8±2.4、内膜保存群の2.5±1.8に比べ有意に多かった(p<0.05)。
平滑筋細胞が中膜から内膜へ遊走する際、内弾性板を破壊している可能性があると考え、局所におけるproteinaseの発現による内弾性板の破壊を仮定し、Matrix Metalloproteinase-1(MMP-1)、Matrix Metalloproteinase-3(MMP-3)の免疫組織染色を行った。右総頚動脈のみを内膜再生した家兎においてPhenylephrineによる両総頚動脈の攣縮誘発24時間後、48時間後に両総頚動脈を摘出した。また、7日間で3回誘発後両総頚動脈を摘出した。右総頚動脈は攣縮群、左総頚動脈は内膜保存群となる。ISDN0.5mg筋注、0.5mg静注し攣縮抑制をしつつPhenylephrineによる攣縮誘発をした攣縮抑制群においても、24時間後、48時間、7日後に右総頚動脈を摘出した。各血管はHemblyの方法に従ってモネンシン処理を行った後、PLP固走液で4℃、1晩固定した。免疫組織染色はABC法を用い、1次抗体としてはMMP-1抗体は抗ヒトMMP-1抗体(マウスモノクローナル抗体)を、MMP-3抗体は抗ウサギMMP-3抗体(マウスモノクローナル抗体)を用いた。
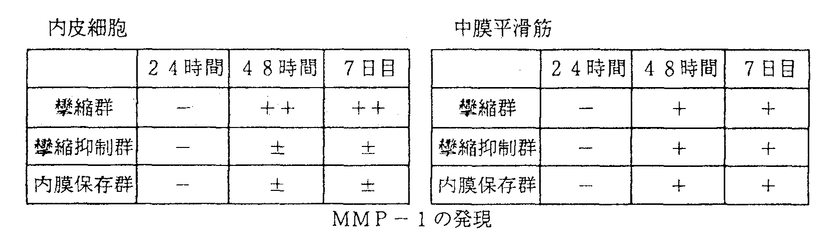 MMP-1の発現
MMP-1の発現 刺激された平滑筋細胞からのMMP-1の発現は24時間から48時間とされており、今回の結果はそれらと一致した。一方、内皮細胞では24時間後では3群ともにMMP-1の発現は認められないが、48時間、7日目では攣縮抑制群、内膜保存群ではMMP-1は発現が非常に少ないか、もしくはほとんど無いのに対し、攣縮群では著明にMMP-1の発現が認められた。攣縮群の7日目ではすでに平滑筋細胞の内膜への遊走が始まっており、それらの平滑筋細胞もMMP-1陽性であった。この結果から平滑筋細胞が中膜内で遊走するときには、平滑筋細胞自体が産生ずるMMP-1によって細胞外マトリックスを分解しているが、内膜への遊走では平滑筋細胞と内皮細胞双方から分泌されるMMP-1の作用によって内弾性板を分解し、そこにできた穴を通過して平滑筋細胞が内膜下へ遊走するのではないかと推測される。攣縮群と内膜保存群の内膜肥厚の差はこの内皮細胞の性質の違いから生じている可能性が、攣縮群と攣縮抑制群の内膜肥厚の差は、攣縮の強さの差により同じ再生内皮細胞でもMMP-1の発現の程度に違いがあることから生じている可能性が推測される。MMP-3は3群ともどの時期にも発現しておらず、平滑筋細胞の遊走、内膜の肥厚には関与していないと思われた。
血管攣縮によってMMP-1が発現する機序については、1)攣縮によって付着した血小板、白血球、マクロファージなどからの成長因子やサイトカインによる刺激で発現、2)攣縮という機械的刺激で発現、が考えられる。MMP-1の発現はいくつかの成長因子やサイトカインによって誘発されることが報告されている。その中でもPDGFとinterleukine-1が重要であると考えられている。今回の研究ではこの2つについて検討したが、PDGFの免疫組織染色については陰性であった。Interleukine-1は現在検討中である。