2.材料と方法 ◆細胞培養:雄WKYラットの胸部大動脈よりexplant法にてVSMCを単離し培養した。
◆NO産生量測定:interleukin-1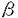 (IL-1
(IL-1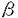 )およびtumor necrosis factor
)およびtumor necrosis factor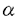 (TNF-
(TNF-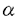 )で培養VSMCを刺激してiNOSを誘導し、培養上清中のnitrite(NO2-)蓄積量をGriessの方法にて発色定量した。
)で培養VSMCを刺激してiNOSを誘導し、培養上清中のnitrite(NO2-)蓄積量をGriessの方法にて発色定量した。
◆iNOS触媒活性測定:PGD2のiNOSに及ぼす直接作用を確認するため、上記のサイトカインでiNOSを誘導させた培養VSMCの細胞ホモジネートに、[3H]arginineとともに諸濃度のPGD2またはNG-monomethyl-L-arginine(L-NMMA)を添加し、2時間・37℃で反応させた。その後Dowex AG50WX-8(Na+)resinを用いて未反応の[3H]arginineを除去し、[3H]citrullineへの転換量を測定して、iNOSの触媒活性とした。
◆蛋白合成量測定:TCA不可溶細胞蛋白分画への[3H]leucineの取り込みを測定した。
◆iNOS蛋白のWestern blot:種々の刺激後の培養VSMCから、2"5’-ADP sepharoseを用いてiNOS蛋白を部分精製し、ラット iNOSの合成ペプチドに対するポリクローン抗体を用いて、iNOS蛋白発現量をWestern blotで評価した。
◆iNOS遺伝子のNorthern blotならびにRT-PCR Southern blot:ラットiNOSのプライマーを用いてRT-PCRを行い、その産物をサブクローニングしてiNOS cDNAプローブを作製した。これを用いて、種々の刺激後の培養VSMCにおけるiNOS mRNA発現量をNorthern blotあるいはRT-PCR Southern blotで評価した。
◆CAT assay:nuclear factor 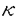 B(NF
B(NF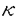 B)やinterferon regulatory factorl(IRF-1)などの転写因子の作用部位を含むiNOS遺伝子のプロモーター領域(-1.7〜+0.5Kb)をchloramphenicol acetyltransferase(CAT)のレポーター(pBLCAT3)に組み込んだプラスミド(piNOSCAT)を、培養VSMCにリポフェクションにて移入し、種々の刺激の後、細胞抽出液中のCAT活性を1-deoxychloramphenicolから3-acetyl-1-deoxychloramphenicolへの転換量として、シリカゲル薄層クロマトグラフィーにて分画評価した。
B)やinterferon regulatory factorl(IRF-1)などの転写因子の作用部位を含むiNOS遺伝子のプロモーター領域(-1.7〜+0.5Kb)をchloramphenicol acetyltransferase(CAT)のレポーター(pBLCAT3)に組み込んだプラスミド(piNOSCAT)を、培養VSMCにリポフェクションにて移入し、種々の刺激の後、細胞抽出液中のCAT活性を1-deoxychloramphenicolから3-acetyl-1-deoxychloramphenicolへの転換量として、シリカゲル薄層クロマトグラフィーにて分画評価した。
3.結果 ◆VSMCにおけるNO産生に及ぼすPGD2の効果:
培養VSMCを20U/ml IL-1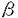 または30ng/ml TNF-
または30ng/ml TNF-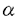 で、PGD2(0〜10-4M)存在下に24時間刺激し、その間の培養上清中のnitrite蓄積量を測定した(Fig.1A,B)。サイトカインの刺激により多量のNO産生が誘導され(49.2±0.57nmoles/106cells/24h byIL-1
で、PGD2(0〜10-4M)存在下に24時間刺激し、その間の培養上清中のnitrite蓄積量を測定した(Fig.1A,B)。サイトカインの刺激により多量のNO産生が誘導され(49.2±0.57nmoles/106cells/24h byIL-1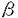 )、PGD2(10-7M以上)はこれを用量依存的に抑制した。
)、PGD2(10-7M以上)はこれを用量依存的に抑制した。
培養VSMCを、10-5Mの種々のプロスタノイド(PGD2,thromboxane A2 analogue,PGI2 analogue,PGE1)と20U/ml IL-1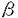 で24時間刺激し、その間のnitrite蓄積量を測定した(Fig.2)。thromboxane A2(TXA2)analogueは軽度にNO産生を抑制し、PGI2 analogue,PGE1はNO産生量を僅かに増加させた。
で24時間刺激し、その間のnitrite蓄積量を測定した(Fig.2)。thromboxane A2(TXA2)analogueは軽度にNO産生を抑制し、PGI2 analogue,PGE1はNO産生量を僅かに増加させた。
次に培養VSMCを、種々の濃度のIL-1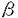 (0〜100U/ml)ならびにPGD2(0,10-6M,10-5M)で24時間刺激し、nitrite蓄積量を測定した(Fig.3)。PGD2は用量反応曲線を右下方へ移動させた。この結果PGD2の抑制作用は、サイトカインの受容体における拮抗作用によるものではないことが示された。
(0〜100U/ml)ならびにPGD2(0,10-6M,10-5M)で24時間刺激し、nitrite蓄積量を測定した(Fig.3)。PGD2は用量反応曲線を右下方へ移動させた。この結果PGD2の抑制作用は、サイトカインの受容体における拮抗作用によるものではないことが示された。
次に培養VSMCを、サイトカイン・カクテルならびにPGD2(0,3x10-5M)で刺激し、24時間後までのnitrite蓄積量の経時変化を調べた(Fig.4)。サイトカインの刺激によりnitrite蓄積量は直線性を示さず加速的に増加し、PGD2はこれを抑制した。
◆Chronological analysis(Fig.5):培養VSMCをサイトカイン・カクテルで刺激後24時間まで、時間をずらしながらPGD2(3x10-5M)を添加し、刺激後24時間のnitrite蓄積量を測定した。刺激開始後6時間以内にPGD2を添加すると十分な抑制効果がみられたが、それ以降では抑制効果は減弱した。この結果、PGD2はiNOSの酵素活性自体ではなく、iNOSの発現を抑制することが推察された。
◆iNOS酵素活性に対するPGD2の効果(Fig.6):培養VSMCを、サイトカイン・カクテルで12時間刺激後洗浄除去した後、20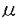 g/mlのシクロヘキシミド(CHX:cycloheximide)で翻訳を停止し、以降8時間のnitrite蓄積量を測定した。サイトカインと同時にPGD2(3x10-5M)を作用させると十分な抑制効果がみられたが(protocol3)、翻訳停止後にPGD2を作用させても抑制効果は全くみられなかった(protocol2)。この結果、PGD2がiNOSの酵素活性自体ではなく、iNOSの発現を抑制することが再確認された。
g/mlのシクロヘキシミド(CHX:cycloheximide)で翻訳を停止し、以降8時間のnitrite蓄積量を測定した。サイトカインと同時にPGD2(3x10-5M)を作用させると十分な抑制効果がみられたが(protocol3)、翻訳停止後にPGD2を作用させても抑制効果は全くみられなかった(protocol2)。この結果、PGD2がiNOSの酵素活性自体ではなく、iNOSの発現を抑制することが再確認された。
◆iNOS触媒活性に対するPGD2の直接効果(Fig.7):細胞ホモジネート中のiNOSの触媒活性に対するPGD2ならびにL-NMMAの効果を測定した。L-NMMAは用量依存的にiNOSの触媒活性を抑制したが、PGD2(〜10-3M)は全く影響しなかった。
◆全蛋白合成に対するPGD2の効果(Table):24時間の培養VSMCによる[3H]leucineの取り込みに対するPGD2(〜10-4M)の影響はなかった。この結果、PGD2によるiNOS発現の抑制は、細胞毒性ないし非特異的効果によるものではないと考えた。
◆iNOS mRNAならびに蛋白発現に対するPGD2の効果(Fig.8):培養VSMCを、20U/ml IL-1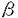 ならびに諸濃度のPGD2で24時間刺激し、iNOS mRNA及び蛋白の発現量を、Northern blot及びWestern blotにて評価した。PGD2は iNOS mRNA及びiNOS蛋白の発現を用量依存的に抑制した。
ならびに諸濃度のPGD2で24時間刺激し、iNOS mRNA及び蛋白の発現量を、Northern blot及びWestern blotにて評価した。PGD2は iNOS mRNA及びiNOS蛋白の発現を用量依存的に抑制した。
◆mRNA stability analysis(Fig.9):培養VSMCを12時間IL-1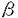 (20U/ml)で刺激後IL-1
(20U/ml)で刺激後IL-1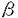 を洗浄除去し、さらに12時間後にPGD2(10-4M)またはvehicleを添加し(前処理)、さらに12時間後に洗浄後再びPGD2またはvehicleとともに、actinomycin D(AMD)(10
を洗浄除去し、さらに12時間後にPGD2(10-4M)またはvehicleを添加し(前処理)、さらに12時間後に洗浄後再びPGD2またはvehicleとともに、actinomycin D(AMD)(10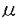 g/ml)またはvehicleを添加し(計4群)、以後24時間iNOS mRNAレベルをRT-PCR Southern blotにて追跡した。AMDによる転写停止下でのiNOS mRNAのdegradation rateはPGD2により影響されなかった(Fig.9A)。またPGD2存在下では、AMD添加によりiNOS mRNAレベルの減退は亢進せず(むしろ減弱し)、このことからもPGD2によるiNOS mRNAの不安定化は否定された(Fig.9B)。従って消去法的に、PGD2によるiNOS遺伝子の転写抑制が示唆された。
g/ml)またはvehicleを添加し(計4群)、以後24時間iNOS mRNAレベルをRT-PCR Southern blotにて追跡した。AMDによる転写停止下でのiNOS mRNAのdegradation rateはPGD2により影響されなかった(Fig.9A)。またPGD2存在下では、AMD添加によりiNOS mRNAレベルの減退は亢進せず(むしろ減弱し)、このことからもPGD2によるiNOS mRNAの不安定化は否定された(Fig.9B)。従って消去法的に、PGD2によるiNOS遺伝子の転写抑制が示唆された。
◆PGD2によるiNOS遺伝子プロモーター転写活性に対する影響(Fig.10):既述のpiNOSCATをトランスフェクトした培養VSMCを、20U/mlIL-1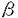 または30
または30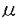 g/ml lipopolysaccharide(LPS)、ならびにPGD2(0〜10-4M)で24時間刺激し、CAT assayを行った。その結果、PGD2による転写活性の抑制は認められなかった。
g/ml lipopolysaccharide(LPS)、ならびにPGD2(0〜10-4M)で24時間刺激し、CAT assayを行った。その結果、PGD2による転写活性の抑制は認められなかった。
◆VSMCにおけるNO産生に及ぼすPGJ2系の効果(Fig.11):PGD2の代謝産物であるPGJ2,△12-PGJ2,15-deoxy-△12-PGJ2は、10-5MにてPGD2よりも強くNO産生を抑制した。全濃度を通して、NO産生抑制作用は、15-deoxy-△12,14-PGJ2が最も強かった。
4.考察 PGD2は培養VSMCにおけるNO産生を抑制した。これは、iNOSの酵素活性自体に対する阻害作用ではなく、iNOS発現過程における転写抑制作用によるものと考えられた。
近年、粥状動脈硬化などの炎症性血管病変において、iNOSの発現が亢進しているという多くの報告がある。さらに粥状硬化巣においては、M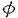 よりもむしろVSMCがNOの主要な産生源である可能性が示唆されている。また粥状硬化巣においては、肥満細胞が病変形成に重要な役割をもつ。一方、PGD2は内皮細胞・血小板・M
よりもむしろVSMCがNOの主要な産生源である可能性が示唆されている。また粥状硬化巣においては、肥満細胞が病変形成に重要な役割をもつ。一方、PGD2は内皮細胞・血小板・M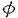 からも産生させるが、さらに、肥満細胞からの分泌顆粒の一部はシクロオキシゲナーゼを含有しPGD2合成能を有する。以上のことと今回の研究結果より、PGD2はこのような血管病変において、NOの過剰産生を抑制する局所メディエーターとして存在する可能性がある。
からも産生させるが、さらに、肥満細胞からの分泌顆粒の一部はシクロオキシゲナーゼを含有しPGD2合成能を有する。以上のことと今回の研究結果より、PGD2はこのような血管病変において、NOの過剰産生を抑制する局所メディエーターとして存在する可能性がある。
PGD2は血小板においてTXA2のアゴニストとして働くが、VSMCにおいてTXA2 an alogueは軽度にNO産生抑制効果を示した。またPGD2は、血小板等においてcAMPを増加させるが、VSMCにおいてcAMPを増加させるPGI2 analogueやPGE1はNO産生を抑制しなかった。最近になって、PGD2の代謝産物であるPGJ2誘導体の一つが、ある種の核内レセプター(PPAR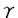 )のリガンドであることが発見された。当研究においても、PGD2の代謝産物であるPGJ2,△12-PGJ2,15-deoxy-△12,14-PGJ2は10-5Mにおいて、より強いNO産生抑制効果を示した。またPGD2は、NF
)のリガンドであることが発見された。当研究においても、PGD2の代謝産物であるPGJ2,△12-PGJ2,15-deoxy-△12,14-PGJ2は10-5Mにおいて、より強いNO産生抑制効果を示した。またPGD2は、NF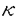 B・IRF-1・NF-IL6・AP-1(activator protein-1)などの転写調節因子の作用部位を含むiNOS遺伝子プロモーター領域の転写活性を抑制しなかった。以上のことを考えあわせると、PGD2の細胞内伝達経路は、TXA2受容体やcAMPあるいは上記諸転写因子を介するのではなく、このようなPGJ2カスケード及びそれらの核内レセプターを介している可能性も考えられるが、この問題の解明には、今後のさらなる研究が待たれる。
B・IRF-1・NF-IL6・AP-1(activator protein-1)などの転写調節因子の作用部位を含むiNOS遺伝子プロモーター領域の転写活性を抑制しなかった。以上のことを考えあわせると、PGD2の細胞内伝達経路は、TXA2受容体やcAMPあるいは上記諸転写因子を介するのではなく、このようなPGJ2カスケード及びそれらの核内レセプターを介している可能性も考えられるが、この問題の解明には、今後のさらなる研究が待たれる。