| 内容要旨 | | (1)緒言 組織特異的に発現するホメオボックス遺伝子は,その組織の発生・分化において重要な役割を果たしていることが知られている.1993年にショウジョウバエの心筋特異的ホメオボックス遺伝子tinmanのmouse homologとしてクローニングされたマウス心筋特異的ホメオボックス遺伝子Csxは,胎児期の早期から心筋にのみ発現しており,また,そのノックアウトマウスで心臓の形成に異常が見られることから,心臓の発生・分化においてきわめて重要な遺伝子であると考えられる.我々は,ヒトの心臓発生の分子機構を解明するためにCsxのhuman homolog(CSX)のクローニングを行い,その解析を試みた. (2)ヒトCSX cDNAのクローニングと遺伝子座位の決定 ヒト胎児心臓cDNAライブラリーをマウスCsx cDNAをプローブとしてスクリーニングし,alternative splicingによって生じると予想される3種類のcDNA,CSX1〜3を得た.CSX1はホメオドメインを含む分子量約35kDaの蛋白をコードするのに対し,CSX2とCSX3は5’側のinsertional sequenceにstop codonが存在し,ホメオドメインを含まない分子量約12kDaの蛋白をコードしていた.CSXのホメオドメインはCsxと比較してアミノ酸レベルで100%,核酸レベルで93%の極めて高い相同性を示し,ショウジョウバエtinmanのホメオドメインとの相同性もアミノ酸レベルで約70%保たれていた.各臓器における発現をノーザンブロット法で検討したところ,CSXは心臓にのみ発現が認められ,特に胎児期に豊富であった.また,RT-PCR法により心臓における各アイソフォームの発現を解析したところ,ホメオドメインを含むCSX1がもっとも豊富に存在していた.以上の結果から,CSX-tinman familyのホメオボックス遺伝子は,進化の過程でその構造および発現様式が非常によく保存された遺伝子群であることが明らかにされ,CSXがヒトの心臓の発生分化に重要な役割を果たしている可能性が強く示唆された. 次に,CSXのヒト染色体における遺伝子座位を,fluorescence in situ hybridization(FISH)法およびCEPH YACライブラリーの3次元PCRスクリーニング法により解析したところ,CSXはヒト第5染色体長腕の5q34にマップされた.この領域には別のホメオボックス遺伝子MSX2も存在し,マウスMsx2が発生段階の心臓の刺激伝導系に発現していることがin situ hybridization法によりすでに明らかにされている.Csxは発生段階の心臓のすべての細胞で発現しており,ヒトの心臓形成においてこれら2つのホメオボックス遺伝子が相互に関連して機能している可能性が示唆された.また5q34が多数のホメオボックス遺伝子がクラスターを形成して存在する染色体上のこれまで知られていない新しい領域である可能性も考えられた. (3)CSX genomic cloneの単離と5’隣接領域(転写調節領域)の解析 CSXのexon-intron構造および5’隣接領域の構造を明らかにする目的で,CSXのgenomic cloneの単離を行った.CSXのcDNAをプローブとして,ヒトgenomic DNA libraryをスクリーニングし,CSX chromosomal regionを含む約20kbのgenomic cloneを得た.CSXは2つのexonと1つのintronから構成されており,5’側の転写開始点の上流約20bpにTATA boxが存在した.またCSX1〜3の3つのcDNA isoformはすべて同じ染色体領域にmapされ,3つのisoformがalternative splicingによって生じることが確認された. 得られたgenomic cloneには約1kbのCSX5’隣接領域が含まれており,この部分にluciferase遺伝子を結合したreporter遺伝子を各種培養細胞にtransfectionすることにより,この領域がCSXの心筋特異的遺伝子発現を制御していることが明らかになった.また,deletion analysisによって,心筋細胞特異的遺伝子発現に重要なcis elementを解析したところ,転写開始点の上流100-120bpに心筋における発現に重要なcis elementが存在することが判明した.この部分にはE-boxおよびMEF2-like AT-rich elementが存在し,CSXの心筋特異的遺伝子発現にbasic helix-loop-helix(bHLH)型の転写因子およびMEF2 familyの転写因子が関与している可能性が考えられた. ショウジョウバエの心筋特異的ホメオボックス遺伝子tinmanに関しては,bHLH型転写因子であるtwistや,TGF-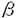 superfamilyに属する増殖因子であるdecapentaplegic(dpp)によってその転写が調節されていることが明らかにされている.しかしながら,twistのmouse homologであるM-twistは予定心臓領域には発現していないこと,twistの無いショウジョウバエのmutantでは心臓がまったく形成されないのに対して,M-twistノックアウトマウスでは心臓が正常に形成されること,さらにM-twistの発現ベクターをCSX5’隣接領域を含むreporter遺伝子とco-transfectionしてもCSXのプロモーター活性の亢進が認められないこと,などから,すくなくともM-twistがCSXの上位に位置し,その転写を制御している可能性は否定的であると考えられる.心臓に発現するbHLH型転写因子としては最近クローニングされたdHAND・eHANDがあり,これらがCSXの遺伝子発現を制御している可能性も考えられるが,発生の過程でCSXはHANDよりも早期にその発現が認められており,少なくともCSXの初期の遺伝子発現調節には関わっていないと推察される.したがってこのcis elementに結合する転写因子群にはCSXの心筋特異的遺伝子発現を制御する未知の因子が含まれているもの考えられ,現在このクローニングを試みている.このようなアプローチによって,心臓の発生において重要な転写因子のカスケードが明らかになるものと考えられる. superfamilyに属する増殖因子であるdecapentaplegic(dpp)によってその転写が調節されていることが明らかにされている.しかしながら,twistのmouse homologであるM-twistは予定心臓領域には発現していないこと,twistの無いショウジョウバエのmutantでは心臓がまったく形成されないのに対して,M-twistノックアウトマウスでは心臓が正常に形成されること,さらにM-twistの発現ベクターをCSX5’隣接領域を含むreporter遺伝子とco-transfectionしてもCSXのプロモーター活性の亢進が認められないこと,などから,すくなくともM-twistがCSXの上位に位置し,その転写を制御している可能性は否定的であると考えられる.心臓に発現するbHLH型転写因子としては最近クローニングされたdHAND・eHANDがあり,これらがCSXの遺伝子発現を制御している可能性も考えられるが,発生の過程でCSXはHANDよりも早期にその発現が認められており,少なくともCSXの初期の遺伝子発現調節には関わっていないと推察される.したがってこのcis elementに結合する転写因子群にはCSXの心筋特異的遺伝子発現を制御する未知の因子が含まれているもの考えられ,現在このクローニングを試みている.このようなアプローチによって,心臓の発生において重要な転写因子のカスケードが明らかになるものと考えられる. (4)CSXの転写因子としての機能の解析 CSXが心臓の発生において重要な転写因子であることはこれまで明らかにされてきたが,CSX蛋白の機能に関しては,そのターゲット遺伝子も含めてほとんど知られていなかった.そこでCSX蛋白の転写因子としての機能の解析を試みた. まず,CSXのターゲット遺伝子を明らかにする目的で,ヒトCSXcDNAを発現ベクターに組み込み,種々の心筋特異的遺伝子のプロモーター領域を含むreporter遺伝子とともにCOS cellに導入し,CSXのtrans-activation活性を解析した.われわれが解析した範囲では,心房性ナトリウム利尿ペプチド(ANP)のプロモーター活性がCSXによって亢進し,ANPがCSXのターゲット遺伝子である可能性が示唆された. 次に,CSX蛋白の機能ドメインを明らかにするために,ヒトCSX cDNAのdeletion mutantを発現ベクターに組み込み,ANPプロモーターを含むreporter遺伝子とともに導入した.N-terminal domainを欠損したmutantでは正常型CSXに比べて転写活性亢進能が低下し,逆にC-terminal domainを欠損したmutantでは正常型CSXに比べて転写活性亢進能が上昇することから,ホメオドメインのN-terminal sideにtransactivation domainが,また,ホメオドメインのC-terminal sideにinhibitory domainが存在することが明らかになった. さらにCSXのdominant-negative mutantを作成するため,ショウジョウバエのホメオボックス遺伝子engrailedとCSXのキメラ蛋白の作成を試みた.engrailedは強力な転写抑制因子であり,ホメオドメインのN-terminal sideにtransrepression domainが存在することが知られている.そこでCSXのtransactivation domainであるN-terminal domainをengrailedのN-terminal domainと交換すれば,CSXのターゲット遺伝子の転写を強力に抑制する転写因子ができるものと期待された.得られた融合遺伝子を発現ベクターに組み込み,CSXの発現ベクターおよびANPプロモーターを含むreporter遺伝子とともに導入したところ,CSXによるANP遺伝子の転写活性亢進はEngrailed-CSXキメラ蛋白によって容量依存性に抑制され,Engrailed-CSXキメラ蛋白がCSXのdominant-negative mutantとして機能することが示された. signal transductionの分野では,受容体のdominant-negative mutantやsmall G proteinなどのdominant-negative mutantが利用され,大きな成果をあげている.さらに最近ではdominant-negative mutantの過剰発現によって,特定の遺伝子の機能を臓器や時期を限定してノックアウトする手法が用いられるようになってきている.京大医学部薬理学教室の斉藤らはレチノイン酸受容体(RAR)のdominant-negative mutantをケラチンのプロモーターを用いて皮膚のみに現局して過剰発現することにより皮膚においてのみRARの機能をノックアウトし,正常な皮膚の形成にRARが必要であることを示した.CSXのノックアウトマウスは胎児期に死亡するため,成人期におけるCSXの機能解析には使用できない. Engrailed-CSXキメラ蛋白を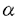 -ミオシン重鎖のような成人期にのみ心筋に発現される遺伝子のプロモーターを用いて過剰発現することにより,成人期のみでCSXの機能をノックアウトすることが可能になるものと期待され,現在この過剰発現マウスを作成中である. -ミオシン重鎖のような成人期にのみ心筋に発現される遺伝子のプロモーターを用いて過剰発現することにより,成人期のみでCSXの機能をノックアウトすることが可能になるものと期待され,現在この過剰発現マウスを作成中である. (5)結語 本研究ではCSXのcDNAクローニング,CSX遺伝子の転写調節領域の解析,およびCSX蛋白の機能解析について述べた.このような解析から,心臓の発生および心筋細胞分化を制御する機構が,分子レベルで明らかにされ,さらにそれらの知見が心不全を含む心臓病の遺伝子治療に応用されることが期待される. |
| 審査要旨 | | 本研究は,心臓の発生分化における転写因子の役割を明らかにするために,心臓発生の初期段階から心臓に限局して発現しているヒト心筋特異的ホメオボックス遺伝子CSXについて解析をおこなったものであり,以下の結果を得ている. 1.ヒトCSXのクローニングと遺伝子座位の決定 ヒト胎児心臓cDNAライブラリーより,alternative splicingによって生じる3種類のcDNA,CSX1〜3を得た.CSX1はホメオドメインを含む分子量約35kDaの蛋白をコードするのに対し,CSX2とCSX3はホメオドメインを欠損した分子量約12kDaの蛋白をコードしていた.CSXホメオドメンのアミノ酸配列はマウス,ショウジョウバエと比較してよく保存されており,その遺伝子発現は心臓に限局して認められた.以上の結果から,CSX-familyのホメオボックス遺伝子は,進化の過程でその構造および発現様式が非常によく保存された遺伝子群であることが明らかにされ,CSXがヒトの心臓の発生分化に重要な役割を果たしている可能性が強く示唆された.また,CSXはヒト第5染色体長腕の5q34にマップされた.この領域には別のホメオボックス遺伝子MSX2も存在し,5q34が多数のホメオボックス遺伝子がクラスターを形成して存在する染色体上のこれまで知られていない新しい領域である可能性も考えられた. 2.CSXの転写調節領域の解析 CSXのプロモーター領域約1kbにluciferase遺伝子を結合したreporter遺伝子を各種培養細胞にtransfectionすることにより,この領域がCSXの心筋特異的遺伝子発現を制御していることが明らかになった.また,deletion analysisによって,心筋細胞特異的遺伝子発現に重要なcis elementを解析したところ,転写開始点の上流100-120bpに心筋における発現に重要なcis elementが存在することが判明した. 3.CSX蛋白の機能解析 CSXのターゲット遺伝子を明らかにする目的で,ヒトCSXcDNAを発現ベクターに組み込み,種々の心筋特異的遺伝子のプロモーター領域を含むreporter遺伝子とともにCOS cellに導入したところ,心房性ナトリウム利尿ペプチド(ANP)のプロモーター活性がCSXによって亢進し,ANPがCSXのターゲット遺伝子である可能性が示唆された.また,CSX蛋白の機能ドメインを明らかにするために,ヒトCSX cDNAのdeletion mutantの解析を行い,ホメオドメインのN-terminal sideにtransactivation domainが,また,ホメオドメインのC-terminal sideにinhibitory domainが存在することが明らかになった.さらにショウジョウバエのホメオボックス遺伝子engrailedのN末ドメインとCSXのキメラ蛋白を,CSXの発現ベクターおよびANPプロモーターを含むreporter遺伝子とともに導入したところ,CSXによるANP遺伝子の転写活性亢進はEngrailed-CSXキメラ蛋白によって容量依存性に抑制され,Engrailed-CSXキメラ蛋白がCSXのdominant-negative mutantとして機能することが示された. 以上,本論文はヒトCSXのcDNAクローニング,CSX遺伝子の転写調節領域の解析,およびCSX蛋白の機能解析から,CSXを中心としたgenetic cascadeの存在を明らかにした.このような解析から,心臓の発生および心筋細胞分化を制御する機構が,分子レベルで明らかにされ,さらにそれらの知見が心不全を含む心臓病の遺伝子治療に応用されることが期待され,学位の授与に値するものと考えられる. |