本研究は、インスリン作用を伝える細胞内情報伝達部質を同定する目的でチロシンリン酸化IRS-1に結合するタンパクのスクリーニングを行い、クローニングしたPI3キナーゼの5種類の調節サブユニットの構造および機能の解析を試みたものであり、下記の結果を得ている。 1.チロシンリン酸化IRS-1をプローブにしたスクリーニングによりヘテロ二量体型のPI3キナーゼの調節サブユニットを得た。既知のp85 ,p85 ,p85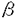 ,p55 ,p55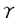 に加え、脳のcDNAライブラリーから55kDaのp55 に加え、脳のcDNAライブラリーから55kDaのp55 、肝臓のcDNAライブラリーから50kDaのp50 、肝臓のcDNAライブラリーから50kDaのp50 の2種類の新規調節サブユニットを発見した。 の2種類の新規調節サブユニットを発見した。 2.p55 はN末端の34アミノ酸が、p50 はN末端の34アミノ酸が、p50 はN末端の6アミノ酸が各々に固有のアミノ酸配列であったが、これらよりC末端側のアミノ酸配列は何れもp85 はN末端の6アミノ酸が各々に固有のアミノ酸配列であったが、これらよりC末端側のアミノ酸配列は何れもp85 のN端側SH2領域直上のproline-rich領域よりC末端側と完全に一致しており、p85 のN端側SH2領域直上のproline-rich領域よりC末端側と完全に一致しており、p85 ,p55 ,p55 ,p50 ,p50 は何れもp85 は何れもp85 遺伝子からalternative splicingによって生じたと考えられた。 遺伝子からalternative splicingによって生じたと考えられた。 3.ノーザンブロットおよびウエスタンブロット解析ではp85 は多くの組織で発現が見られたのに対し、p55 は多くの組織で発現が見られたのに対し、p55 は脳と骨格筋に、p50 は脳と骨格筋に、p50 は脳、肝臓、腎臓に強い発現が見られた。臓器ごとに各調節サブユニットの分布が異なっており、各調節サブユニットはシグナルを伝える上で独自の役割を果たしていることが予想された。 は脳、肝臓、腎臓に強い発現が見られた。臓器ごとに各調節サブユニットの分布が異なっており、各調節サブユニットはシグナルを伝える上で独自の役割を果たしていることが予想された。 4.p85 ,p85 ,p85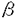 ,p55 ,p55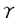 ,p55 ,p55 ,p50 ,p50 の5種類の調節サブユニットに結合したPI3キナーゼ活性のインスリン刺激への反応性を比較した。PC12細胞の場合、p50 の5種類の調節サブユニットに結合したPI3キナーゼ活性のインスリン刺激への反応性を比較した。PC12細胞の場合、p50 に結合したものはインスリン刺激によって約3.2倍に、p85 に結合したものはインスリン刺激によって約3.2倍に、p85 またはp55 またはp55 に結合したものは約2倍に活性が上昇し、p85 に結合したものは約2倍に活性が上昇し、p85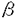 またはp55 またはp55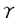 に結合したものはインスリン刺激の有無で活性の変化を示さなかった。HepG2細胞の場合、p85 に結合したものはインスリン刺激の有無で活性の変化を示さなかった。HepG2細胞の場合、p85 ,p85 ,p85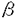 ,p50 ,p50 の3種類の調節サブユニットを発現しているが、p50 の3種類の調節サブユニットを発現しているが、p50 に結合したものはインスリン刺激によって約4.6倍に、p85 に結合したものはインスリン刺激によって約4.6倍に、p85 に結合したものは約2.7倍に活性が上昇し、p85 に結合したものは約2.7倍に活性が上昇し、p85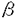 に結合したものはインスリン刺激の有無で活性の変化を示さなかった。免疫沈降に用いた抗体の違いによる影響を除外するため、アデノウイルスを用いて各調節サブユニットをHepG2細胞に過剰発現させ、調節サブユニットに共通のHA tagに対する抗体で免疫沈降し、PI3キナーゼ活性を測定した。p50 に結合したものはインスリン刺激の有無で活性の変化を示さなかった。免疫沈降に用いた抗体の違いによる影響を除外するため、アデノウイルスを用いて各調節サブユニットをHepG2細胞に過剰発現させ、調節サブユニットに共通のHA tagに対する抗体で免疫沈降し、PI3キナーゼ活性を測定した。p50 に結合したものはインスリン刺激によって約25倍の非常に高度の活性上昇を示した。p85 に結合したものはインスリン刺激によって約25倍の非常に高度の活性上昇を示した。p85 ,p55 ,p55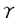 ,p55 ,p55 に結合したものは2倍から6倍の活性上昇を示した。一方p85 に結合したものは2倍から6倍の活性上昇を示した。一方p85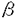 に結合したものはインスリン刺激の有無で活性の変化を示さなかった。インスリン受容体あるいはIRS-1を過剰発現しているCHO細胞にアデノウイルスを用いて各調節サブユニットを過剰発現させ、tagの抗体で免疫沈降させてPI3キナーゼ活性を測定した場合もHepG2細胞に過剰発現させた場合と同様に、p50 に結合したものはインスリン刺激の有無で活性の変化を示さなかった。インスリン受容体あるいはIRS-1を過剰発現しているCHO細胞にアデノウイルスを用いて各調節サブユニットを過剰発現させ、tagの抗体で免疫沈降させてPI3キナーゼ活性を測定した場合もHepG2細胞に過剰発現させた場合と同様に、p50 に結合したPI3キナーゼ活性はp85 に結合したPI3キナーゼ活性はp85 ,p55 ,p55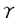 ,p55 ,p55 に比較し、インスリンに非常に高度に反応した。一方p85 に比較し、インスリンに非常に高度に反応した。一方p85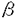 に結合したPI3キナーゼ活性はインスリン刺激に有意な反応を示さなかった。調節サブユニットの種類によってPI3キナーゼ活性が異なるよう調節されていることが明らかとなった。 に結合したPI3キナーゼ活性はインスリン刺激に有意な反応を示さなかった。調節サブユニットの種類によってPI3キナーゼ活性が異なるよう調節されていることが明らかとなった。 5.インスリン受容体によってチロシンリン酸化されたIRS-1タンパクへの親和性を比較するため、アデノウイルスを用いて各調節サブユニットを過剰発現させた細胞を[35S]メチオニン ラベルし、インスリン刺激の有無で調節サブユニットと結合するタンパクの変化を調べた。IRS-1と考えられる180kDaのタンパクがインスリン刺激によって非常に効率良くp50 に結合した。リン酸化IRS-1タンパクとの高い親和性がインスリン刺激時の高度の活性上昇の原因と考えられた。p50 に結合した。リン酸化IRS-1タンパクとの高い親和性がインスリン刺激時の高度の活性上昇の原因と考えられた。p50 はp85 はp85 、p55 、p55 と共通のアミノ酸配列よりN末端側に6アミノ酸しか持たず、N末端で何らかの構造を作って別のタンパクと結合するには不十分と考えられた。したがってp85 と共通のアミノ酸配列よりN末端側に6アミノ酸しか持たず、N末端で何らかの構造を作って別のタンパクと結合するには不十分と考えられた。したがってp85 とp55 とp55 のN末端の構造がIRS-1との親和性を低下させていることが推測された。 のN末端の構造がIRS-1との親和性を低下させていることが推測された。 以上、本論文はPI3キナーゼの新規調節サブユニットを発見し、これまで既知の調節サブユニットも含め、構造と機能の解析を行った。PI3キナーゼのアイソフォーム間でのシグナル伝達の比較はこれまでほとんど知られていない。インスリン作用におけるPI3キナーゼの役割の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |