嚢胞性繊維腫症(Cystic fibrosis,CF)は、コーカサス人種において最も頻度の高い致死性遺伝疾患である。その責任遺伝子は1989年に同定され、疾患の原因が気道、腸管、膵外分泌腺など分泌上皮を中心に発現するcAMP依存性Cl-イオンチャネル(Cystic Fibrosis Transmembrane conductance Regulator,CFTR)の突然変異であることが判明した。CFに伴う種々の病態のうち、最も重大な問題は慢性呼吸器感染症であり、抗生剤治療の継続にも関わらず、最終的に細菌叢が多剤耐性緑膿菌へと変化、重症肺炎に伴う呼吸不全から死に至る症例が多い。患者の平均寿命は30歳前後である。 CFに伴う呼吸器合併症に対する積極的治療の試みを大きく分類すると、(1)気道上皮における分泌の改善、(2)局所炎症の制御、および(3)遺伝子突然変異に伴う異常の矯正がある。本論文は、このうち(1)と(3)について、新たな可能性を模索するものである。 第1部では、慢性肺感染症の原因と考えられる気道上皮の電解質分泌異常について、CFTRの突然変異に伴うcAMP依存性Cl-コンダクタンスの失調を補間する可能性のあるCa2+/カルモジュリン依存性Cl-分泌機構を、ミクロソームに存在し細胞質内Ca2+イオン濃度([Ca2+]i)を制御するCa2+-ATPaseの阻害により活性化する試みを報告する。 Ca2+-ATPase阻害剤のthapsigargin(THG)、cyclopiazonic acid(CPA)、および2,5-di-(tert-butyl)-1,4-hydroquinone(DBHQ)は、細胞質内に放出されたCa2+の再吸収を阻害することにより[Ca2+]i上昇を惹起することが知られている。DBHQは、毒性の報告されていない市販の合成化学物質で、その化学構造は細胞毒性のあるTHGおよびCPAとは全く関連をもたない。本研究では、全CF患者の約70%がもつ△F508(CFTRにおける第508アミノ残基のフェニルアラニンの欠損)の突然変異を示した患者より樹立されたヒト膵臓由来上皮性細胞CFPAC-1を用いて、DBHQによるCa2+依存性Cl-分泌機構活性化を介したCl-分泌改善の可能性を検討した。 まずDBHQは、125Iを用いた陰イオン流出率測定実験(Anion efflux study)において125I流出率を増加させる効果を示した。これはDBHQがCl-コンダクタンスを誘導し得ることの間接的証明である。 続いてCa2+感受性色素Fura-2を用いた実験から、DBHQ濃度依存性に[Ca2+]iの上昇が認められ、その効果は25-50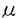 Mで最大であった。また細胞外Ca2+をBAPTA(1,2-bis-(o-aminophenoxy)ethane-N,N,N’,N’-tetraacetic acid)によりキレートした条件下では、DBHQ(25 Mで最大であった。また細胞外Ca2+をBAPTA(1,2-bis-(o-aminophenoxy)ethane-N,N,N’,N’-tetraacetic acid)によりキレートした条件下では、DBHQ(25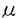 M)はマイクロソーム内Ca2+プールの放出によると考えられる短期的な[Ca2+]i上昇をもたらした。陰イオン流出率測定実験における細胞外液には1.2mMのCa2+を含むが、この条件でDBHQ(25 M)はマイクロソーム内Ca2+プールの放出によると考えられる短期的な[Ca2+]i上昇をもたらした。陰イオン流出率測定実験における細胞外液には1.2mMのCa2+を含むが、この条件でDBHQ(25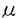 M)は持続的な[Ca2+]iの上昇を生じ、一方これはCa2+チャネル阻害剤のNi2+(5mM)を細胞外液に加えたところ概ね消失した。 M)は持続的な[Ca2+]iの上昇を生じ、一方これはCa2+チャネル阻害剤のNi2+(5mM)を細胞外液に加えたところ概ね消失した。 Whole cell patch clamp法による全細胞CTチャネルコンダクタンスの測定では、DBHQを細胞外液に加えると、Ca2+/カルモジュリン依存性CTチャネルに特徴的なプロファイルをもつ、外向き整流性全細胞Cl-コンダクタンスが誘導された。このコンダクタンスは、細胞内に交通する測定用ピペット内溶液へのBAPTA(5mM)添加、および多機能性Ca2+/カルモジュリン依存性蛋白リン酸化酵素CaMKIIの阻害性ペプチドであるCaMK[273-302](20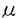 M)の添加により消失した。 M)の添加により消失した。 CFPAC-1細胞の単層培養にDBHQを加えると、4-5分で細胞ホモジェネート液中にCa2+依存性ないし自律性CaMKII活性の有意な上昇が認められた。従ってDBHQは、CaMKIIを介したCa2+依存性メカニズムによりCl-チャネルコンダクタンスを誘導するものと考えられた。 DBHQの短期的細胞毒性に関する検討では、CFPAC-1細胞を50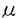 MまでのDBHQに6時間曝露したが、曝露後における生存細胞数、および曝露開始後48時間までの細胞増殖能に有意な変化は認められなかった。 MまでのDBHQに6時間曝露したが、曝露後における生存細胞数、および曝露開始後48時間までの細胞増殖能に有意な変化は認められなかった。 これらの結果から、適切な選択的ミクロソームCa2+-ATPase阻害剤は、CFの上皮細胞においてCl-イオンの細胞外への分泌を促進し、治療的に有効である可能性が示された。 他方、CFに対する遺伝子治療の試みとしては、現在までアデノウイルスベクターおよび陽性脂質リポソーム法による臨床第1相試験が米国および英国で実施されたが、前者に関してはベクター自体の免疫原性が誘導する抗原抗体反応が、また後者は低い遺伝子導入効率が問題となった。遺伝子治療の進展には、より安全で高効率な遺伝子導入法の開発が不可欠である。 第2部では、センダイウイルス(Hemmagglutinating Virus of Japan:HVJ)の細胞膜融合能に着目して開発されたHVJ-リポソーム法について、これを2種のCF患者由来ヒト気道上皮細胞株および正常マウス肺に適用し、本遺伝子導入法のCF治療における可能性に関する初期的な検討を行った。 HVJ-リポソーム法は、紫外線照射により生物学的に不活化したHVJウィルスのカプシドを中性脂質リポソームにコーティングすることにより、リポソームに細胞膜融合能を賦与し、リポソーム内に封入したDNAをはじめとするマクロ分子の標的細胞への導入を実現する方法である。発現プラスミドベクターDNAの導入に際しては、DNAの核内移行促進作用が報告されている核蛋白質HMG-1(High mobility group 1)を併用した。 本研究では、まず本法のヒト気道上皮CF細胞株、CFNPE(変異未同定)およびCFPEo-(△F508)における遺伝子導入効率を評価するため、大腸菌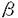 -galactosidaseを発現するプラスミドベクターpSV-LacZを用いた検討を行った。2種のCF細胞株に対してHVJ-リポソーム法(HMG-1併用、以下特記なき場合は同様)は、等量以上のpSV-LacZDNAを陽性脂質リポソーム法(Lipofectin,Gibco BRL)にて導入した場合と比較し、約4-5倍の -galactosidaseを発現するプラスミドベクターpSV-LacZを用いた検討を行った。2種のCF細胞株に対してHVJ-リポソーム法(HMG-1併用、以下特記なき場合は同様)は、等量以上のpSV-LacZDNAを陽性脂質リポソーム法(Lipofectin,Gibco BRL)にて導入した場合と比較し、約4-5倍の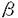 -galactosidase活性を発現した。この際、全細胞における遺伝子導入細胞の割合はおよそ15-25%であった。 -galactosidase活性を発現した。この際、全細胞における遺伝子導入細胞の割合はおよそ15-25%であった。 続いて、HVJ-リポソーム法による、野生型CFTRのCF細胞株における発現を検討した。 まず4.7kb CFTR cDNAをpSR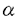 プロモーター下流に挿入し、CFTR発現ベクターpSR プロモーター下流に挿入し、CFTR発現ベクターpSR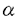 -CFTRを得た。本ベクターをHVJ-リポソーム法にて導入後、標的細胞より調整した高分子DNA試料をSouthern法で解析、CFTR cDNAの導入を確認した。また、標的細胞より調整した全RNA試料をNorthern法により解析したところ、HVJ-リポソーム法ではHMG-1併用時に陽性脂質リポソーム法と比較して有意に高いCFTR mRNAを検出したが、HMG-1非併用時のHVJ-リポソーム法によるCFTR mRNA量は著しく低下した。 -CFTRを得た。本ベクターをHVJ-リポソーム法にて導入後、標的細胞より調整した高分子DNA試料をSouthern法で解析、CFTR cDNAの導入を確認した。また、標的細胞より調整した全RNA試料をNorthern法により解析したところ、HVJ-リポソーム法ではHMG-1併用時に陽性脂質リポソーム法と比較して有意に高いCFTR mRNAを検出したが、HMG-1非併用時のHVJ-リポソーム法によるCFTR mRNA量は著しく低下した。 次に、pSR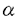 -CFTRのHVJ-リポソーム法による導入にて、cAMP依存性Cl-コンダクタンスに変化が生じるかを125Iを用いた陰イオン流出率測定実験にて評価した。細胞外液に3種のCFTRアゴニスト(200 -CFTRのHVJ-リポソーム法による導入にて、cAMP依存性Cl-コンダクタンスに変化が生じるかを125Iを用いた陰イオン流出率測定実験にて評価した。細胞外液に3種のCFTRアゴニスト(200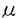 MCPT-cAMP,10 MCPT-cAMP,10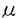 M forskolin,1mM isobutylmethylxanthine)を加えたのちの流出率増加を検討したところ、pSR M forskolin,1mM isobutylmethylxanthine)を加えたのちの流出率増加を検討したところ、pSR -CFTR導入群は両CF細胞において3-4%/分の流出率増加が認められ、非導入群に対して有意に高値であった。 -CFTR導入群は両CF細胞において3-4%/分の流出率増加が認められ、非導入群に対して有意に高値であった。 最後にHVJ-リポソームの肺内投与における有効性の検討を、非CFマウス(C57BL/6)を用いて行った。pSV-LacZをHVJ-リポソーム法にてマウス気管内より注入し、48時間後に両側肺を摘出、細胞ホモジェネート中の -galactosidase活性を測定したところ、pSV-LacZ投与群では非投与対照群に比較して有意に高値を示した。但し、非投与群においても内因性と考えられる比較的高い -galactosidase活性を測定したところ、pSV-LacZ投与群では非投与対照群に比較して有意に高値を示した。但し、非投与群においても内因性と考えられる比較的高い -galactosidase活性が認められ、その有効性に関しては定性的な評価が許されるにとどまった。 -galactosidase活性が認められ、その有効性に関しては定性的な評価が許されるにとどまった。 以上、HVJ-リポソーム法はヒト気道上皮由来CF細胞株2種において陽性脂質リポソーム法に勝る遺伝子導入効率を示し、さらに野生型CFTRの発現によりCFTRの司るcAMP依存性CTコンダクタンスの部分的回復が可能であった。また非CFマウス肺への投与では、定性的に遺伝子導入能が認められた。本法のCF遺伝子治療への適用可能性は、今後ヒト初代培養気道上皮細胞、CFTR標的破壊マウスを用いた検討、加えて霊長類動物を用いた安全性の検討等によりさらに評価される必要がある。 |