下垂体腺腫は成人の脳腫瘍の約6-18%を占め、GH産生腺腫はその内訳の第2位を占める。GH産生下垂体腺腫は放置すると糖尿病、高血圧、心疾患などの罹患率の上昇、更には寿命の短縮をもたらす重大な疾患である。この疾患の病態の理解には、GH過剰分泌の機構の解明が不可欠である。GH産生下垂体細胞からのGHの分泌調節については、生理的な分泌刺激因子であるGHRHによるものが重要である。この細胞からのGH分泌は細胞内Ca2+濃度によって制御されており、GHRH投与時の細胞内Ca2+濃度上昇にはcAMPによるプロテインキナーゼA(PKA)の活性化を介したイオン機構の挙動が密接に関わっている。すなわち、PKAの活性化により非選択性陽イオン電流および電位依存性Ca2+電流の増加を介して細胞内へのCa2+流入が起こり、細胞内Ca2+濃度が上昇する。この機構は一部のGH産生ヒト下垂体腺腫でも確認されており、cAMP抑制性の薬剤であるソマトスタチンやブロモクリプチンが治療に用いられる背景となっている。GH産生下垂体腺腫の病態の理解におけるもう一つの重要な点は、Gs 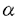 を持続的に活性化する遺伝子異常(gsp変異)が同定されていることである。しかしこれまでGH分泌調節に重要なイオン機構とgsp変異の関連については知られていなかった。 を持続的に活性化する遺伝子異常(gsp変異)が同定されていることである。しかしこれまでGH分泌調節に重要なイオン機構とgsp変異の関連については知られていなかった。 私たちは、今回GHRHによって非選択性陽イオン電流及び電位依存性Ca2+電流が増加しないヒトGH産生下垂体腺腫に遭遇した。電気生理学的に更に検討したところ、cAMP類似薬の8Br-cAMPの投与でもこれらの電流は増加せず、PKAの阻害剤であるRp-cAMPSによってベースの状態でこれらの電流が減少した。以上から、この腺腫のイオン機構のGHRHに対する不応性はGHRH受容体の欠如または機能低下ではなく、PKAがベースの状態ですでに活性化されているためと考えられた。私たちはこの現象がgsp変異によるものではないかと考え、分子生物学的に検討した。ヒトのGs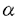 遺伝子はゲノム中に1コピーしかなく、現在までに報告されているgsp変異はすべてそのコドン201または227のミスセンス変異である。そこで、初代培養腺腫細胞を集めてmRNAを抽出後、RT-PCR法によりGs 遺伝子はゲノム中に1コピーしかなく、現在までに報告されているgsp変異はすべてそのコドン201または227のミスセンス変異である。そこで、初代培養腺腫細胞を集めてmRNAを抽出後、RT-PCR法によりGs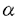 cDNAのコドン201と227を含む部分を増幅し、直接塩基配列決定を行った。その結果、コドン227から野生型のグルタミンと変異型のロイシンの両者が検出された。ところでこの解析で用いた細胞には培養中に混在する線維芽細胞なども混入しているため、腺腫細胞がこの変異についてヘテロ接合性かホモ接合性かを区別できない。このいずれであるかを決定するため、電気生理学的手法を応用して単一腺腫細胞からmRNAを抽出し遺伝子を増幅するsingle cell RT-PCR法を行った。その結果、変異型と野生型の両者が検出された。GH産生下垂体腺腫はその大部分が単クローン性に増殖したものであることが知られているため、この腺腫がgsp変異のヘテロ接合体であることが判明した。片方のアレルだけが変異型であることは、gsp変異が活性化変異であることを裏付けるものである。この腺腫を有していた患者の白血球ではGs cDNAのコドン201と227を含む部分を増幅し、直接塩基配列決定を行った。その結果、コドン227から野生型のグルタミンと変異型のロイシンの両者が検出された。ところでこの解析で用いた細胞には培養中に混在する線維芽細胞なども混入しているため、腺腫細胞がこの変異についてヘテロ接合性かホモ接合性かを区別できない。このいずれであるかを決定するため、電気生理学的手法を応用して単一腺腫細胞からmRNAを抽出し遺伝子を増幅するsingle cell RT-PCR法を行った。その結果、変異型と野生型の両者が検出された。GH産生下垂体腺腫はその大部分が単クローン性に増殖したものであることが知られているため、この腺腫がgsp変異のヘテロ接合体であることが判明した。片方のアレルだけが変異型であることは、gsp変異が活性化変異であることを裏付けるものである。この腺腫を有していた患者の白血球ではGs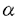 のコドン227は野生型であり、gsp変異が体細胞変異によって下垂体に出現したものと考えられた。 のコドン227は野生型であり、gsp変異が体細胞変異によって下垂体に出現したものと考えられた。 この腺腫ではgsp変異により非選択性陽イオン電流及び電位依存性Ca2+電流がともに最大限に活性化されていることが示された。この関係が他のGH産生下垂体腺腫にも当てはまるか否かを調べるため、更に連続する22人症例のGH産生下垂体腺腫を用いて検討した。以後の検討では非選択性陽イオン電流と電位依存性Ca2+電流のうち、前者のみを調べた。また、以後、最初の腺腫と後続の22個の腺腫を併せて論ずる。 合計23例中、gsp変異は16例に認められた。うち検索し得た5例ではsingle cell RT-PCR法によりすべてがヘテロ接合体と確認された。また、16例中調べ得た3例では患者白血球の解析の結果gsp変異はなく、体細胞変異であると考えられた。16例のうち調べ得た14例中13例で非選択性陽イオン電流はGHRHに対して反応せず、変異のある腺腫では一般にこの電流はGHRHに不応性であると考えられた。また、GHRHに対するcAMP産生能、細胞内Ca2+濃度、及びGH分泌の反応性もこの群では予測されたとおりに不良であった。一方、非選択性陽イオン電流のGHRHに対する不応性は変異のない腺腫7例中3例にも見られ、GHRHレセプターなどGs 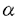 以外の活性化変異の可能性が示唆された。変異のない腺腫では、GHRHに対するcAMP産生能、細胞内Ca2+濃度、及びGH分泌の反応性も多彩であった。 以外の活性化変異の可能性が示唆された。変異のない腺腫では、GHRHに対するcAMP産生能、細胞内Ca2+濃度、及びGH分泌の反応性も多彩であった。 多症例の検討からは、思いがけない結果も得られた。すなわち、GH産生下垂体腺腫におけるgsp変異の頻度がこれまでのどの報告よりも高いことである。今回の結果では最初の症例も含めると23例中16例(69.6%)にgsp変異が認められた。欧米での頻度は30-40%程度、日本の症例ではそれより更に少なく10%以下と報告されている。従来の報告との頻度のずれは、変異の検出方法の違いによる可能性がある。gsp変異の真の頻度が今回の報告に近いのであれば、従来GH産生下垂体腺腫の一部にしか寄与していないと考えられていたgsp変異が実は一番主要な病因であることを意味しており、大変意義深い。 これまで日本ではgsp変異の同定された患者が少なく、その臨床的特徴はまとめられていなかったため、今回検討を加えた。手術時の年齢は、変異のある群(44.0±9.7)の方がない群(55.3±7.3)よりも約10年低かった(P=0.012)。これは欧米の報告には見られなかった知見である。欧米で意見の分かれていた血中GH基礎値は変異のある群で62.0±96.4ng/ml(n=15)、変異のない群で10.5±8.8(n=5)であり、変異のある群の方が高値であった(P=0.018)。性比および血中IGF-I値は従来の報告通り両群に差はなかった。 GHRH負荷に対する血中GHの上昇は、健康成人では軽微であり、加齢と共に反応性がなくなっていくことが知られている(特に50歳以上)。多くのGH産生下垂体腺腫に見られるGHRH負荷に対するGHの明らかな上昇はむしろ病的であり、過大反応と呼ばれている。今回の検討でGHRHに対するGHの過大反応(倍率)は変異のある群で1.75±0.41 (n=11)、変異のない群で11.5±6.0 (n=3)であり、変異のない群の方が有意に著明であった(P<0.0001)。また両群にオーバーラップは認められなかった。gsp変異のある腺腫を持つ患者はソマトスタチン及びブロモクリプチンによく反応することが知られているが、ソマトスタチン負荷試験10例、ブロモクリプチン負荷試験9例の変異を有する患者の検討の結果、いずれも血中GH値は抑制され、従来の見解が追認された。また、正常のGH産生細胞ではTRHやLHRHの投与によってGH分泌は変化しないが、GH産生下垂体腺腫にはGH分泌が増加する奇異反応が見られることがあり、レセプターの発現異常など何らかの細胞内の制御機構の逸脱を反映していると考えられている。変異を有する群では負荷試験を行った全例でTRHに対する奇異性上昇反応が認められ(n=11)、LHRHに対する奇異反応は見られなかった(n=10)。もともとGH産生下垂体腺腫の多くはTRHに対する奇異反応を示し、またLHRHに対する奇異反応は一部の腺腫にのみ見られるものなので意義付けは難しいが、興味深い結果である。gsp変異を有する患者のこれら各種のホルモン及び薬物負荷試験に対するGHの反応性の有無は、従来の欧米の報告とおおむね一致した。 以上を総括すると、gsp変異を有する腺腫ではそのほとんどがGHRHに対する非選択性陽イオン電流の増加反応を欠くことがわかった。また、詳しく見ればこの群には個々の腺腫で違いがあり、不均一性が存在するものの、全体として見れば非選択性陽イオン電流に加えて他の細胞内刺激伝達系のGHRHに対する反応パターンも比較的類似していることが示された(cAMP産生量の増加は少なく、細胞内Ca2+濃度は変化せず、GH分泌の増加もあったとしても軽度である)。臨床データにおいても、ホルモンの基礎値の分布は広い幅をとったがGHRHを始めとする薬剤に対しては共通する反応を示した(GHRHに対するGHの増加反応は少なく、ソマトスタチン及びブロモクリプチンによりGHはよく抑えられ、TRHには奇異性上昇反応をし、LHRHには無反応)。これに対し、gsp変異のない群では多様な結果が得られ、不均一な群であると考えられた。この群の腺腫の中にもGHRHに対する非選択性陽イオン電流の増加が見られないものがあり、Gs 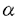 以外のGHRHシグナル伝達系の活性化変異(GHRHレセプターなど)の存在が示唆された。また今回の検討ではgsp変異の頻度が従来の報告よりかなり高いという重要な知見も得られた。 以外のGHRHシグナル伝達系の活性化変異(GHRHレセプターなど)の存在が示唆された。また今回の検討ではgsp変異の頻度が従来の報告よりかなり高いという重要な知見も得られた。 GH産生下垂体腺腫の病態には、GHの過剰分泌とGH産生下垂体細胞の増殖という少なくとも2つの側面がある。今回の報告も含めた多くの研究から、gsp変異がGH過剰分泌を起こすことが証明されている。後者についても、多くの優れた研究からgsp変異がGH産生下垂体細胞の増殖を招くことが認めれられている。一方、gsp変異のない腺腫の病因についてはほとんど知られていない。今後、gsp変異以外の病因が解明されることが強く望まれる。 |